
分析 (1)根據配制一定物質的量濃度的溶液使用的儀器解答;
(2)根據由碘單質參加的反應選擇使用的指示劑,根據反應前溶液顏色及反應后溶液判斷滴定終點;
(3)根據反應找出反應關系式,然后根據題中數據計算出碘鹽中KIO3的質量分數;
(4)根據滴定管沒有潤洗導致待裝液濃度偏低.
解答 解:(1)配制250mL溶液用到的儀器有托盤天平、藥匙、玻璃棒、膠頭滴管、燒杯、250mL容量瓶、量筒(可用可不用),膠頭滴管,故還需要的玻璃儀器有:250mL容量瓶,
故答案為:250mL容量瓶;
(2)步驟二中生成I2,可以使用淀粉作為指示劑;加入淀粉,溶液呈藍色,用Na2S2O3溶液滴定,I2反應完畢,溶液藍色褪色,滴定終點現象為:溶液藍色褪色,半分鐘內不恢復藍色,
故答案為:當滴入最后一或半滴Na2S2O3溶液時,溶液的藍色褪去,且半分鐘內溶液不恢復藍色;
(3)25mL溶液消耗Na2S2O3的物質的量為c mol•L-1×0.012L=0.012mol,故250mL溶液應消耗Na2S2O3的物質的量為0.012cmol×10=0.12cmol,令250mL溶液中KIO3的物質的量為xmol,則:
KIO3~3I2~6Na2S2O3
1 6
xmol 0.12cmol
所以x=0.02c
故加碘鹽中KIO3的質量分數$\frac{0.02cmol×214g/mol}{ag}$×100%=$\frac{4.28c}{a}$×100%,
故答案為:$\frac{4.28c}{a}$×100%;
(4)滴定前滴定管沒有用Na2S2O3溶液潤洗,導致滴定過程中消耗的Na2S2O3溶液體積偏大,測定的碘酸鉀的物質的量偏大,測定結果偏高;
故答案為:偏高.
點評 本題考查氧化還原滴定的應用、對實驗原理理解與實驗裝置的評價、閱讀獲取信息的能力,難度中等,是對知識的綜合運用與分析解決問題能力的考查,注意基礎知識的掌握.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
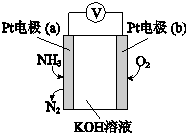
| A. | O2在電極b上發生還原反應 | |
| B. | 溶液中OH-向電極b移動 | |
| C. | 反應消耗的NH3與O2的物質的量之比為4:3 | |
| D. | 負極的電極反應式為:2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
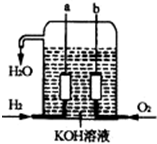 美國阿波羅宇宙飛船上使用的氫氧燃料電池是一種新型的化學電池,其構造如圖所示;兩個電極均由多孔性碳制成,通入的氣體由孔隙中逸出,并在電極表面放電.
美國阿波羅宇宙飛船上使用的氫氧燃料電池是一種新型的化學電池,其構造如圖所示;兩個電極均由多孔性碳制成,通入的氣體由孔隙中逸出,并在電極表面放電.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者產生的氫氣一樣多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 第三周期元素的離子半徑從左到右依次減小 | |
| B. | HCl、PCl5、N2、CO2分子中所有原子都滿足最外層8電子的結構 | |
| C. | 晶體內可以不存在化學鍵,也可以同時存在離子鍵和共價鍵 | |
| D. | 若某離子化合物X2Y3中X3+和Y2-的電子層結構相同,則X、Y兩元素的原子序數之差可能是5、15或29 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com