
甲醇是一種可再生能源,具有廣泛的開發和應用前景。
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反應符合“原子經濟”原則的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列數據是反應Ⅰ在不同溫度下的化學平衡常數(K)。
溫度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷,ΔH1______0(填“>”、“=”或“<”)。
③某溫度下,將2 mol CO和6 mol H2充入2 L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為________,此時的溫度為________(從上表中選擇)。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:______________________________________。
(1)①Ⅰ ②< ③80% 250 ℃
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-1
【解析】 (1)①反應Ⅰ的產物只有甲醇,而反應Ⅱ的產物有兩種,故反應Ⅰ符合“原子經濟”原則;②觀察圖表數據可得,升溫時,K值變小,說明該反應的正反應為放熱反應,即ΔH1<0;③CO的轉化率為(2 mol-0.2 mol·L-1×2 L)/2 mol×100%=80%;此時的化學平衡常數為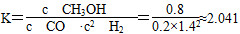 ,故此時的溫度為250 ℃。(2)將三個熱化學方程式進行變形:[①+(-②)+4×③]×
,故此時的溫度為250 ℃。(2)將三個熱化學方程式進行變形:[①+(-②)+4×③]×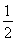 ,可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式,即CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×
,可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式,即CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×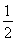 =
=
-442.8 kJ·mol-1。


科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 高考模擬演練1練習卷(解析版) 題型:填空題
鹵素性質活潑,能形成鹵化物、多鹵化物等多種類型的化合物。
(1)鹵化氫中,HF的沸點高于HCl,原因是____________________________
____________________________________________。
(2)如圖為F-與Mg2+、K+形成的某種離子晶體的晶胞,其中“○”表示的離子是________(填離子符號)。
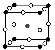
(3)多鹵化物Rb[ICl2]分解時生成晶格能相對較大的銣(Rb)的鹵化物,則該鹵化物的化學式為_______________。
(4)BF3與NH3能發生反應生成X(H3BNF3),X的結構式為____________(用“→”表示出配位鍵):X中B原子的雜化方式為____________________________。
(5)有一類物質的性質與鹵素類似,稱為“擬鹵素”[如(SCN)2、(CN)2等]。(CN)2的結構式為CNCN,該分子中σ鍵和π鍵數目之比為________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第8講電化學練習卷(解析版) 題型:選擇題
電解裝置如圖所示,電解槽內裝有KI及淀粉溶液,中間用陰離子交換膜隔開。在一定的電壓下通電,發現左側溶液變藍色,一段時間后,藍色逐漸變淺。

已知:3I2+6OH-=IO3—+5I-+3H2O
下列說法不正確的是( )。
A.右側發生的電極反應式:2H2O+2e-=H2↑+2OH-
B.電解結束時,右側溶液中含IO3—
C.電解槽內發生反應的總化學方程式:KI+3H2O KIO3+3H2↑
KIO3+3H2↑
D.如果用陽離子交換膜代替陰離子交換膜,電解槽內發生的總化學反應不變
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第6講化學反應速率和化學平衡練習卷(解析版) 題型:填空題
2012年11月16日,5名男孩被發現死于貴州省畢節市七星關區街頭垃圾箱內,經當地公安部門初步調查,5名男孩是因在垃圾箱內生火取暖導致CO中毒而死亡。
(1)CO中毒是由于CO與血液中血紅蛋白的血紅素部分反應生成碳氧血紅蛋白,反應的化學方程式可表示為CO+HbO2 O2+HbCO,實驗表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,實驗表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力損傷。已知t ℃時上述反應的平衡常數K=200,吸入肺部O2的濃度約為1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力損傷。已知t ℃時上述反應的平衡常數K=200,吸入肺部O2的濃度約為1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,則吸入肺部CO的濃度不能超過________mol·L-1。
,則吸入肺部CO的濃度不能超過________mol·L-1。
(2)有如下三個與CO相關的反應:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常數K1
FeO(s)+CO(g) ΔH=Q1,平衡常數K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常數為K2
FeO(s)+H2(g) ΔH=Q2,平衡常數為K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常數為K3
CO(g)+H2O(g) ΔH=Q3,平衡常數為K3
在不同的溫度下K1、K2、K3的數值如下:
T/℃ | K1 | K2 | K3 |
700 | 1.47 | 2.38 | 0.62 |
900 | 2.15 | 1.67 |
|
請回答下列問題:
①Q1、Q2、Q3的關系式:Q3=________。
②K1、K2、K3的關系式:K3=________,根據此關系式可計算出上表中900 ℃時,K3的數值為________(精確到小數點后兩位)。可進一步推斷反應H2(g)+CO2(g)??CO(g)+H2O(g)為________(填“放”或“吸”)熱反應,Q3________0(填“>”、“<”或“=”)。③改變條件使可逆反應H2(g)+CO2(g) CO(g)+H2O(g)已經建立的平衡逆向移動,可采取的措施有________。
CO(g)+H2O(g)已經建立的平衡逆向移動,可采取的措施有________。
A.縮小容器體積 B.降低溫度 C.使用催化劑 D.設法增加H2O(g)的量
E.升高溫度
(3)在一定條件下,使CO和O2的混合氣體13 g充分反應,所得混合氣體在常溫下與足量的Na2O2固體反應,結果固體增重7 g,則原混合氣體中CO的質量是________g。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第6講化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
一定條件下,向容積為2 L的密閉容器中充入1 mol CO2和3 mol H2,發生如下反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反應達到平衡時c(CH3OH)為0.2 mol·L-1。CO2(g)的平衡物質的量濃度c(CO2)與溫度關系如圖所示。下列說法錯誤的是( )。
CH3OH(g)+H2O(g),5 min后反應達到平衡時c(CH3OH)為0.2 mol·L-1。CO2(g)的平衡物質的量濃度c(CO2)與溫度關系如圖所示。下列說法錯誤的是( )。

A.0~5 min,CO2的平均反應速率為0.04 mol·(L·min)-1
B.反應CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
C.在T2 ℃時,若反應處于狀態D,則一定有v正<v逆
D.若T1 ℃、T2 ℃時的平衡常數分別為K1、K2,則K1>K2
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第5講化學反應與能量練習卷(解析版) 題型:選擇題
已知:①1 g氫氣在氧氣中完全燃燒生成氣態水,放出熱量120.9 kJ,②中和熱為57.3 kJ·mol-1,③C(石墨s)=C(金剛石s) ΔH=+1.90 kJ·mol-1,下列說法正確的是( )。
A.氫氣的燃燒熱為241.8 kJ·mol-1
B.氫氣燃燒的熱化學方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1
C.鹽酸和氨水混合的熱化學方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D.由③可知金剛石不及石墨穩定
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第4講物質結構元素周期律練習卷(解析版) 題型:填空題
X、Y、Z、L、M五種元素的原子序數依次增大。X、Y、Z、L是組成蛋白質的基礎元素,M是地殼中含量最高的金屬元素。
回答下列問題:
(1)L的元素符號為________;M在元素周期表中的位置為________;五種元素的原子半徑從大到小的順序是________(用元素符號表示)。
(2)Z、X兩元素按原子數目比1∶3和2∶4構成分子A和B,A的電子式為________,B的結構式為________。
(3)硒(Se)是人體必需的微量元素,與L同一主族,Se原子比L原子多兩個電子層,則Se的原子序數為________,其最高價氧化物對應的水化物化學式為________,該族二~五周期元素單質分別與H2反應生成1 mol氣態氫化物的反應熱如下,表示生成1 mol硒化氫反應熱的是________(填字母代號)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M單質作陽極,石墨作陰極,NaHCO3溶液作電解液進行電解,生成難溶物R,R受熱分解生成化合物Q。寫出陽極生成R的電極反應式:_________________________;由R生成Q的化學方程式為____________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第3講兩種重要的化學反應練習卷(解析版) 題型:選擇題
下列解釋事實的方程式不準確的是( )。
A.用濃鹽酸檢驗氨:NH3+HCl=NH4Cl
B.碳酸鈉溶液顯堿性:CO32—+H2O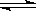 HCO3—+OH-
HCO3—+OH-
C.鋼鐵發生吸氧腐蝕時,鐵作負極被氧化:Fe-3e-=Fe3+
D.長期盛放石灰水的試劑瓶內壁出現白色固體:Ca(OH)2+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第13講實驗方案設計與評價練習卷(解析版) 題型:實驗題
用氯化鐵浸出?重鉻酸鉀(K2Cr2O7)滴定法測定鈦精粉試樣中單質鐵的質量分數[w(Fe)],實驗步驟如下:
步驟1:稱取試樣0.100 g于250 mL洗凈的錐形瓶中。
步驟2:加入FeCl3溶液100 mL,迅速塞上膠塞,用電磁攪拌器攪拌30 min。
步驟3:過濾,用水洗滌錐形瓶和濾渣各3~4次,洗液全部并入濾液中。
步驟4:將濾液稀釋至500 mL,再移取100 mL稀釋液于錐形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸鈉指示劑4滴。
步驟5:以K2Cr2O7標準溶液滴定至出現明顯紫色為終點。發生的反應為Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟6:重復測定兩次。
步驟7:數據處理。
(1)步驟2中加入FeCl3溶液后錐形瓶中發生反應的離子方程式為________________,迅速塞上膠塞的原因是______________________________
(2)步驟3中判斷濾紙上殘渣已洗凈的方法是_____________________________
(3)實驗中需用到100 mL濃度約為0.01 mol·L-1K2Cr2O7標準溶液,配制時用到的玻璃儀器有________________。稱量K2Cr2O7固體前應先將其烘干至恒重,若未烘干,對測定結果的影響是________(填“偏高”、“偏低”或“無影響”);滴定時,K2Cr2O7溶液應置于________(填儀器名稱)中。
(4)科研人員為確定FeCl3溶液的最佳濃度,選用100 mL不同濃度的FeCl3溶液(FeCl3溶液均過量)溶解同一鈦精粉試樣,其余條件控制相同,得到測定結果如圖所示。則FeCl3溶液的濃度[用ρ(FeCl3)表示]范圍應為________g·L-1,濃度過低或過高時測定結果偏低的原因分別是_________________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com