
大氣中的部分碘源于O3對海水中I-的氧化。將O3持續通入NaI溶液中進行模擬研究。
(1)O3將I-氧化成I2的過程由3步反應組成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
總反應的化學方程式為_________________________________,
其反應熱ΔH=______________。
(2)在溶液中存在化學平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常數表達式為________。
I3-(aq),其平衡常數表達式為________。
(3)為探究Fe2+對O3氧化I-反應的影響(反應體系如圖1),某研究小組測定兩組實驗中I3-濃度和體系pH,結果見圖2和下表。

編號 | 反應物 | 反應前pH | 反應前pH |
第1組 | O3+I- | 5.2 | 11.0 |
第2組 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1組實驗中,導致反應后pH升高的原因是______________。
②圖1中的A為________。由Fe3+生成A的過程能顯著提高I-的轉化率,原因是____________________。
③第2組實驗進行18 s后,I3-濃度下降。導致下降的直接原因有(雙選)________。
A.c(H+)減小
B.c(I-)減小
C.I2 (g)不斷生成
D.c(Fe3+)增加
(4)據圖2,計算3~18 s內第2組實驗中生成I3-的平均反應速率(寫出計算過程,結果保留兩位有效數字)。
(1)O3(g)+2I-(aq)+2H+(aq)=O2(g)+I2(aq)+H2O(l) ΔH1+ΔH2+ΔH3
(2)K=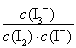
(3)①H+被消耗,其濃度降低 ②Fe2+ Fe3+氧化I-生成I2,使I-的轉化率顯著提高 ③BD
(4)反應時間:18 s-3 s=15 s,I3-濃度變化:11.8×10-3mol·L-1-3.5×10-3mol·L-3mol·L-1=8.3×10-3mol·L-1,v(I3-)= ≈5.5×10-4mol·(L·s)-1
≈5.5×10-4mol·(L·s)-1
【解析】利用蓋斯定律、化學反應速率、化學平衡的影響因素等分析及計算,逐步解決問題。
(1)根據蓋斯定律,由①+②+③可得總反應為2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),則ΔH=ΔH1+ΔH2+ΔH3。(2)所給反應的平衡常數表達式為K= 。(3)①第1組實驗中,pH升高是因為反應消耗了H+。②圖1中的A為Fe2+,由Fe3+生成Fe2+的過程中,I-被氧化為I2,因此I-的轉化率顯著提高。③導致I3-濃度下降的原因是c(Fe3+)增加,使c(I-)減小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移動。(4)v(I3-)=
。(3)①第1組實驗中,pH升高是因為反應消耗了H+。②圖1中的A為Fe2+,由Fe3+生成Fe2+的過程中,I-被氧化為I2,因此I-的轉化率顯著提高。③導致I3-濃度下降的原因是c(Fe3+)增加,使c(I-)減小,平衡I2(aq)+I-(aq)??I3-(aq)逆向移動。(4)v(I3-)=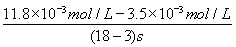 ≈5.5×10-4mol·(L·s)-1。
≈5.5×10-4mol·(L·s)-1。
點撥:知識:反應熱、化學反應速率、化學平衡常數。能力:考查考生對化學反應原理的理解能力。試題難度:中等。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學能與熱能練習卷(解析版) 題型:選擇題
美國某技術公司開發出納米級催化劑,可在較低溫度下將甲烷轉化成乙烯:2CH4(g)??C2H4(g)+2H2(g) ΔH,已知在降低溫度時該反應平衡向左移動,且有下列兩個反應(Q1、Q2均為正值):
反應Ⅰ:C(s)+2H2(g)=CH4(g) ΔH1=-Q1
反應Ⅱ:C(s)+H2(g)= 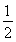 C2H4(g) ΔH2=-Q2
C2H4(g) ΔH2=-Q2
則下列判斷正確的是( )
A.ΔH<0 B.Q2>Q1 C.ΔH=2(Q1-Q2) D.ΔH=Q1-Q2
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本理論練習卷(解析版) 題型:選擇題
短周期主族元素X、Y、Z、W的原子序數依次增大,其原子的最外層電子數之和為19。X的簡單陰離子比W的簡單陰離子少2層電子,Y與Z位于相鄰周期,Z的氧化物排放到空氣中會形成酸雨。下列說法正確的是( )
A.四種元素中,元素Z的非金屬性最強
B.X、Y、Z三種元素不可能形成離子化合物
C.Y、Z、W三種元素的原子半徑大小順序:r(W)>r(Z)>r(Y)
D.YW3、ZW2、Z2W2中各原子最外層均達到8電子穩定結構
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本概念練習卷(解析版) 題型:選擇題
在Cu2S+2Cu2O 6Cu+SO2↑反應中,說法正確的是( )
6Cu+SO2↑反應中,說法正確的是( )
A.Cu2O在反應中被氧化
B.Cu2S在反應中既是氧化劑又是還原劑
C.Cu既是氧化產物又是還原產物
D.若反應中轉移12 mol電子,則生成6 mol Cu
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學基本概念練習卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.無色溶液:K+、Na+、Cu2+、SO42—
B.c(OH-)=10-13mol· L-1的溶液:Al3+、NO3—、I-、Cl-
C.水電離產生的c(H+)=10-13mol·L-1的溶液:Na+、Cl-、NO3—、SO42—
D.0.1 mol·L-1 FeSO4溶液:K+、NH4+、MnO4—、ClO-
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學反應速率與化學平衡練習卷(解析版) 題型:選擇題
在一個密閉絕熱容器(W)中,進行如下兩個可逆反應:①A(g)+2B(g)  3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反應①中各物質與反應②中各物質均不發生反應。在某容器里只進行反應②,M的轉化率與溫度、壓強的關系如圖所示。
3Q(g) ΔH2。反應①中各物質與反應②中各物質均不發生反應。在某容器里只進行反應②,M的轉化率與溫度、壓強的關系如圖所示。

下列對W容器中進行的反應推斷合理的是( )
A.反應①一定是自發反應,反應②一定是非自發反應
B.若容器內溫度保持不變,則v正(B):v逆(C)=2:3
C.若恒壓條件下,充入N,則C的物質的量減小
D.升高溫度,兩個反應的平衡常數都減小
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學與技術練習卷(解析版) 題型:填空題
工業生產Na2S常用方法是無水芒硝(Na2SO4)一碳還原法,其流程示意圖如下:

(1)若煅燒階段所得氣體為等物質的量的CO和CO2。寫出煅燒時發生的總反應方程式:______________________。
(2)用堿液浸出產品比用熱水更好,理由是__________________。
(3)廢水中汞常用硫化鈉除去,汞的除去率與溶液pH和硫化鈉實際用量與理論用量比值x的關系如圖所示。為使除汞達到最佳效果,應控制條件是________________。

(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分攪拌,若反應后溶液pH=4,此時溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效數字)]。
(5)納米Cu2O常用電解法制備,制備過程用銅棒和石墨棒做電極,Cu(NO3)2做電解液。電解生成Cu2O應在________;該電極pH將________(填“升高”“不變”或“降低”),用電極方程式解釋pH發生變化的原因______________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 元素及其化合物練習卷(解析版) 題型:選擇題
相對分子質量為100的烴,且含有4個甲基的同分異構體共有(不考慮立體異構)( )
A.3種 B.4種 C.5種 D.6種
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第7講水溶液中的離子平衡練習卷(解析版) 題型:填空題
難溶性雜鹵石(K2SO4·MgSO4·2CaSO4·2H2O)屬于“呆礦”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
為能充分利用鉀資源,用飽和Ca(OH)2溶液溶浸雜鹵石制備硫酸鉀,工藝流程如下:

(1)濾渣主要成分有________和________以及未溶雜鹵石。
(2)用化學平衡移動原理解釋Ca(OH)2溶液能溶解雜鹵石浸出K+的原因:
_____________________________________________________________。
(3)“除雜”環節中,先加入________溶液,經攪拌等操作后,過濾,再加入________溶液調濾液pH至中性。

(4)不同溫度下,K+的浸出濃度與溶浸時間的關系如圖。由圖可得,隨著溫度升高,
①_______________________________________________________,
②_______________________________________________________。
(5)有人以可溶性碳酸鹽為溶浸劑,則溶浸過程中會發生:CaSO4(s)+CO32— CaCO3(s)+SO
CaCO3(s)+SO
已知298 K時,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此溫度下該反應的平衡常數K(計算結果保留三位有效數字)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com