
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)已知:2SO2(g)+O2(g)  2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
則反應NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定條件下,將NO2與SO2以體積比2∶1置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是
A.體系壓強保持不變
B.混合氣體顏色保持不變
C.SO3和NO的體積比保持不變
D.每消耗1molSO3的同時生成1mol NO
測得上述反應達平衡時NO2與SO2的體積比為5∶1,則平衡常數K=
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)  CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖(2)所示。該反應ΔH 0(填“>”或“<”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是: 。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖(2)所示。該反應ΔH 0(填“>”或“<”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是: 。
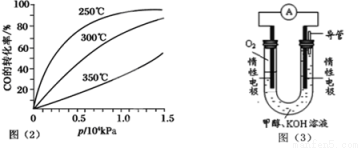
(4)依據燃燒的反應原理,合成的甲醇可以設計如圖(3)所示的原電池裝置。
①該電池工作時,OH-向 極移動(填“正”或“負”)。
②該電池正極的電極反應式為 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年福建省高一下學期期末化學試卷(解析版) 題型:填空題
下表是元素周期表的一部分,表中的每個字母表示一種短周期元素,回答下列問題:
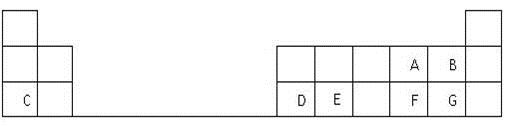
(1)G在元素周期表中的位置是 。
(2)A、B、C三種元素的簡單離子半徑由大到小的順序為 (用離子符號表示)。
(3)寫出C和F兩種元素形成的化合物的電子式 ,
(4)元素E是構成地殼的主要元素之一,其氧化物是制光導纖維的基本原料,該氧化物中含有的化學鍵是 鍵(填“離子”或“共價”),屬于 晶體(填晶體類型),寫出該氧化物與C元素最高價氧化物水化物反應的離子方程式 。
(5)C離子的氧化性比D離子的氧化性 ,(填“強”或“弱”),其原因是 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下學期第四次月考化學試卷(解析版) 題型:選擇題
下列有關物質的分離或提純的說法中正確的是( )
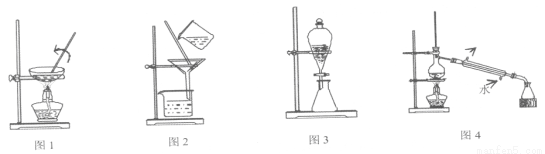
A.圖①:從FeCl2溶液中制取FeCl2晶體
B.圖②:從制取Fe(OH)3膠體的混合物中提純膠體
C.圖③:用CCl4萃取,從溴水中得到純溴
D.圖④:分離苯和甲苯
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高二下學期期末化學試卷(解析版) 題型:選擇題
向盛有硫酸銅水溶液的試管里加入氨水,首先形成難溶物,繼續添加氨水,難溶物溶解得到深藍色的透明溶液。下列對此現象說法正確的是 ( )
A.反應后溶液中不存在任何沉淀,所以反應前后Cu2+的濃度不變。
B.沉淀溶解后,將生成深藍色的配合離子[Cu(NH3)4] 2+。
C.向反應后的溶液加入乙醇,溶液沒有發生變化 。
D.在[Cu(NH3)4] 2+離子中,Cu2+給出孤對電子,NH3提供空軌道。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高二下學期期末化學試卷(解析版) 題型:選擇題
下列分子或離子中,中心原子含有孤對電子的是
A.NH4+ B.CCl4 C.SiH4 D.H3P
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省廈門市高一下學期期末化學試卷(解析版) 題型:選擇題
己知反應A(g)+B(g)  C(g)+D(g)的平衡常數K值與溫度的關系如下表所示.830℃時,向一個2L的密閉容器中充入0.20molA和0.80molB,4s內v(A)=0.005 mol·L-1·S-1.
C(g)+D(g)的平衡常數K值與溫度的關系如下表所示.830℃時,向一個2L的密閉容器中充入0.20molA和0.80molB,4s內v(A)=0.005 mol·L-1·S-1.
下列說法正確的是( )
溫度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A.4s時,c(B)為0.76 mol·L-1
B. 830℃到平衡時,A的轉化率為80%
C. 達平衡時,升高溫度,平衡正向移動
D.1200 ℃時反應C(g)+D(g)  A(g)+B(g)的平衡常數的值為0.4
A(g)+B(g)的平衡常數的值為0.4
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省廈門市高一下學期期末化學試卷(解析版) 題型:選擇題
一定條件下,制備特種陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)ΔH>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( )
MgO(s)+CO2(g)+SO2(g)ΔH>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( )
選項 | x | y |
|
A | 溫度 | 容器內混合氣體的密度 | |
B | CO的物質的量 | CO2與CO的物質的量之比 | |
C | SO2的濃度 | 平衡常數K | |
D | MgSO4的質量(忽略體積) | CO的轉化率 |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省廈門市高二下學期期末化學試卷(解析版) 題型:填空題
FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小,請回答下列問題:
(1)FeCl3凈水的原理是_________________;
(2)為節約成本,工業上用NaClO3氧化酸性FeCl2廢液得到FeCl3。若酸性FeCl2廢液中c(Fe2+)=2.0×10-2mol•L-1,c(Fe3+)=1.0×10-3mol•L-1,c(Cl-)=5.3×10-2mol•L-1,則該溶液的pH約為_________________;
(3)FeCl3在溶液中分三步水【解析】
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反應的平衡常數K1、K2、K3由大到小的順序是_________________;
(4)通過控制條件,以上水解產物聚合,生成聚合氯化鐵,離子方程式為:xFe3++yH2O?Fex(OH)y(3x-y)++yH+,欲使平衡正向移動可采用的方法是(填序號)_________________
a.降溫 b.加水稀釋 c.加入NH4Cl d.加入NaHCO3
(5)室溫下,使氯化鐵溶液轉化為高濃度聚合氯化鐵的關鍵條是_________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省洞口縣高二下學期期末化學試卷(解析版) 題型:選擇題
下列圖中的實驗方案,能達到實驗目的的是
A | B | C | D | |
實驗方案 |
|
|
|
|
實驗 目的 | 驗證FeCl3對H2O2分解反應有催化作用 | 制備Fe(OH)2并能較長時間觀察其顏色 | 除去CO2氣體中混有的SO2 | 比較HCl、H2CO3和H2SiO3的酸性強弱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com