
| 物質 | X | Y | Z |
| 初始物質的量/mol | 2 | 4 | 0 |
| 4 min末物質的量/ihol | 1.6 | 2.8 | a |
| 平衡物質的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃該反應的平衡常數為4 | |
| C. | 前4min內,用Z的變化量表示的平均反應速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的體系溫度,V逆:增大,V正增大,平衡向逆反應方向移動 |
分析 發生反應:X(g)+3Y(g)?2Z(g)
初始:(mol) 2 4 0
變化量:(mol)1 3 2
平衡:(mol) 1 1 2,
平衡時各組分濃度為:c(X)=$\frac{1mol}{2L}$0.5mol/L、c(Y)=$\frac{1mol}{2L}$=0.5mol/L、c(Z)=$\frac{2mol}{2L}$=1mol/L,
A.4min時X的物質的量變化為:2mol-1.6mol=0.4mol,根據計量數關系計算出a;
B.根據平衡常數的概念及表達式計算出該反應的平衡常數;
C.根據A可知a=0.8,則前4min內,根據v=$\frac{\frac{△n}{V}}{△t}$進行計算;
D.該反應為放熱反應,升高溫度后正逆反應速率都增大,平衡向著逆向移動,據此進行解答.
解答 解:發生反應:X(g)+3Y(g)?2Z(g)
初始:(mol) 2 4 0
變化量:(mol)1 3 2
平衡:(mol) 1 1 2,
平衡時各組分濃度為:c(X)=$\frac{1mol}{2L}$0.5mol/L、c(Y)=$\frac{1mol}{2L}$=0.5mol/L、c(Z)=$\frac{2mol}{2L}$=1mol/L,
A.4min時X的物質的量變化為:2mol-1.6mol=0.4mol,根據反應可知,此時Z的物質的量為:0.4mol×2=0.8mol,即a=0.8,故A正確;
B.該溫度下該反應的平衡常數為:K=$\frac{{1}^{2}}{0.{5}^{3}×0.5}$=16,故B錯誤;
C.根據A可知a=0.8,則前4min內,用Z的變化量表示的平均反應速率V(Z)=$\frac{\frac{0.8mol}{2L}}{4min}$=0.1mol•L-1•min-1 ,故C正確;
D.該反應為放熱反應,升高溫度后平衡向著逆向移動,且正逆反應速率都增大,故D正確;
故選B.
點評 本題考查了化學平衡的計算,題目難度中等,明確化學平衡及其影響為解答關鍵,注意掌握三段式在化學平衡計算中的應用,試題培養了學生的分析能力及化學計算能力.


 課課通課程標準思維方法與能力訓練系列答案
課課通課程標準思維方法與能力訓練系列答案科目:高中化學 來源: 題型:選擇題
| A | B | C | |
| 濃度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 濃度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 濃度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 濃度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[濃度3]與[濃度1]的比較,可判斷平衡移動的原因是增大了體系的壓強 | |
| B. | 由[濃度2]與[濃度1]的比較,可判斷正反應是放熱反應 | |
| C. | [濃度1]中a=0.05 | |
| D. | 該組某學生在實驗①過程中,測得各物質在某一時刻的濃度為[濃度4].與[濃度1]比較,可發現該同學在測定[濃度4]這組數據時出現了很大的誤差 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅粒與稀硫酸的反應 | |
| B. | 灼熱的木炭與CO2的反應 | |
| C. | Ba(OH)2•8H2O晶體與NH4Cl晶體的反應 | |
| D. | 甲烷在空氣中燃燒的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
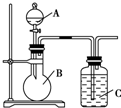 某同學設計如圖裝置,研究非金屬元素性質變化規律.
某同學設計如圖裝置,研究非金屬元素性質變化規律.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
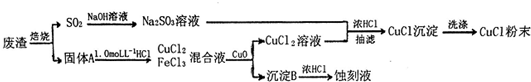
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
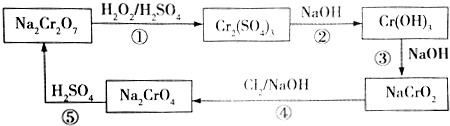
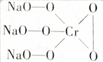 ,則Cr的化合價為+5,其中含有的化學鍵有離子鍵、共價鍵.
,則Cr的化合價為+5,其中含有的化學鍵有離子鍵、共價鍵.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com