
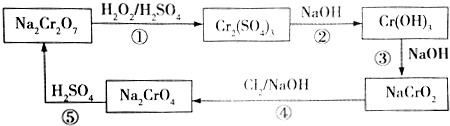
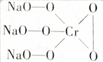
 ,則Cr的化合價為+5,其中含有的化學(xué)鍵有離子鍵、共價鍵.
,則Cr的化合價為+5,其中含有的化學(xué)鍵有離子鍵、共價鍵.分析 Cr2O72-具有強氧化性,在酸性溶液中能將H2O2氧化為O2,的硫酸鉻,溶液中加入氫氧化鈉生成氫氧化鉻,繼續(xù)加入氫氧化鈉溶液,氫氧化鉻溶解得到NaCrO2,類似于氫氧化鋁的性質(zhì),在NaCrO2溶液中通入氯氣發(fā)生氧化還原反應(yīng)生成Na2CrO4,加入硫酸轉(zhuǎn)化為Na2Cr2O7,
(1)根據(jù)化合物化合價代數(shù)和為0結(jié)合陰離子結(jié)構(gòu)為 解答;
解答;
(2)反應(yīng)①重鉻酸鈉在酸性溶液中和過氧化氫發(fā)生氧化還原反應(yīng)生成硫酸鉻,過氧化氫被氧化生成氧氣,結(jié)合氧化還原反應(yīng)電子守恒和化學(xué)方程式定量關(guān)系就是得到一件和還原劑物質(zhì)的量之比;
(3)根據(jù)反應(yīng)②③,可知Cr(OH)3可以和強堿反應(yīng),生成NaCrO2,說明Cr(OH)3顯示弱酸性,存在一步電離,從反應(yīng)③可以看出,Cr(OH)3可以與NaOH溶液反應(yīng)生成NaCrO2,所以除去Fe3+中的Cr3+時,可以加入過量的NaOH溶液,使Cr3+轉(zhuǎn)化為CrO,F(xiàn)e3+轉(zhuǎn)化為Fe(OH)3沉淀,在過濾得到的Fe(OH)3中加入鹽酸即得到FeCl3溶液;
(4)步驟⑤中,Cr元素的化合價從+3升高到了+6價,所以需要加入氧化劑Cl2,在堿性溶液中發(fā)生氧化還原反應(yīng);
(5)根據(jù)氧化還原反應(yīng)中得失電子數(shù)相等,再結(jié)合原子守恒進行計算.
解答 解:(1)因為化合物化合價代數(shù)和為0,又化學(xué)式Na3CrO8中陰離子結(jié)構(gòu)可表示為 ,則氧為-1價,鈉為+1價,所以鉻為+5,化合物中含有化學(xué)鍵類型為離子鍵、共價鍵,
,則氧為-1價,鈉為+1價,所以鉻為+5,化合物中含有化學(xué)鍵類型為離子鍵、共價鍵,
故答案為:+5;離子鍵、共價鍵;
(2)H2O2既具有氧化性,又具有還原性;Cr2O72-具有強氧化性,能將H2O2氧化為O2,反應(yīng)中+6價Cr元素被還原為+3價,離子反應(yīng)為Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O,氧化劑和還原劑物質(zhì)的量之比為1:3,
故答案為:1:3;
(3)根據(jù)反應(yīng)②③,可知Cr(OH)3可以和強堿反應(yīng),生成NaCrO2,說明Cr(OH)3顯示弱酸性,存在一步電離,電離方程式為:Cr(OH)3?H2O+CrO2-+H+,從反應(yīng)③可以看出,Cr(OH)3可以與NaOH溶液反應(yīng)生成NaCrO2,所以除去Fe3+中的Cr3+時,可以加入過量的NaOH溶液,使Cr3+轉(zhuǎn)化為CrO,F(xiàn)e3+轉(zhuǎn)化為Fe(OH)3沉淀,在過濾得到的Fe(OH)3中加入鹽酸即得到FeCl3溶液,
故答案為:Cr(OH)3?H2O+CrO2-+H+;CrO2-;Fe(OH)3;
(4)步驟⑤中,Cr元素的化合價從+3升高到了+6價,所以需要加入氧化劑Cl2,在堿性溶液中發(fā)生氧化還原反應(yīng),鉻元素化合價+3價變化為+6價,氯元素化合價0價變化為-1價,結(jié)合電子守恒、電荷守恒和原子守恒配平書寫離子方程式為:2CrO2-+3Cl2+8OH-=2CrO42-+6Cl-+4H2O,
故答案為:2CrO2-+3Cl2+8OH-=2CrO42-+6Cl-+4H2O;
(5)處理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根據(jù)鉻原子守恒得,1mol Cr2O72-完全反應(yīng)后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根據(jù)鐵原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,該反應(yīng)中得失電子數(shù)相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,將x=1.5代入①得a=10,
故答案為:D.
點評 本題考查較為綜合,涉及實驗操作、離子方程式的書寫、電子守恒的計算等,題目難度中等,解答本題,要充分把握題給信息,牢固掌握物質(zhì)的性質(zhì).


 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學(xué) 來源: 題型:選擇題
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| 物質(zhì) | X | Y | Z |
| 初始物質(zhì)的量/mol | 2 | 4 | 0 |
| 4 min末物質(zhì)的量/ihol | 1.6 | 2.8 | a |
| 平衡物質(zhì)的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃該反應(yīng)的平衡常數(shù)為4 | |
| C. | 前4min內(nèi),用Z的變化量表示的平均反應(yīng)速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的體系溫度,V逆:增大,V正增大,平衡向逆反應(yīng)方向移動 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
 )與P(
)與P( ),下列有關(guān)它們的說法中正確的是( )
),下列有關(guān)它們的說法中正確的是( )| A. | 二者的核磁共振氫譜中均只出現(xiàn)兩種峰且峰面積之比為3:1 | |
| B. | 二者在NaOH醇溶液中均可發(fā)生消去反應(yīng) | |
| C. | 一定條件下,二者在NaOH溶液中均可發(fā)生取代反應(yīng) | |
| D. | Q的一氯代物只有1種,P的一溴代物有2種 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | CO的燃燒熱為283 kJ | |
| B. |  如圖可表示由CO生成CO2的反應(yīng)過程和能量關(guān)系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)與Na2O2(s)反應(yīng)放出509 kJ熱量時,生成53gNa2CO3(s) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 .
. ,試寫出Cu、稀硫酸與X反應(yīng)制備硫酸銅的離子方程式Cu+2H++H2O2=Cu2++2H2O.
,試寫出Cu、稀硫酸與X反應(yīng)制備硫酸銅的離子方程式Cu+2H++H2O2=Cu2++2H2O.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 該有機物分子中碳、氫、氧原子個數(shù)比為1:2:3 | |
| B. | 該有機物中肯定不含氧 | |
| C. | 該有機物分子中碳、氫原子個數(shù)比為1:2 | |
| D. | 該有機物中肯定含有氧 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
 水是生命之源,2014年我國科學(xué)家首次拍攝到水分子團簇的空間取向圖象,模型如圖所示,下列關(guān)于水的說法正確的是( )
水是生命之源,2014年我國科學(xué)家首次拍攝到水分子團簇的空間取向圖象,模型如圖所示,下列關(guān)于水的說法正確的是( )| A. | 水是弱電解質(zhì),某溫度下,純水的pH=6,則說明顯酸性 | |
| B. | 可燃冰是可以燃燒的水 | |
| C. | 在相同溫度下,水的電離常數(shù)與水的離子積常數(shù)相等 | |
| D. | 在水中加入Na或NaH,都將促進水的電離 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com