
 元素周期表的用途廣泛.
元素周期表的用途廣泛.| 離子半徑 | 非金屬性 | 酸性 | 沸點 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
分析 (1)電子層排布相同,核電荷數越大離子半徑越小;
同一周期自左而右,非金屬性增強;
元素的非金屬性越強,對應的最高價氧化物的水化物的酸性越強;
HF中含氫鍵,沸點最高,HBr、HCl中相對分子質量大的沸點高;
(2)非金屬性單質氧化性越強,元素非金屬性越強,氫化物穩定性、最高價含氧酸的酸性、單質與氫氣反應難易程度、元素化合時化合價等可以判斷元素非金屬性強弱,熔點屬于物理性質,不能比較元素非金屬性強弱,氫化物酸性也不能比較非金屬性強弱;
(3)①電解時,陽極上氯離子放電生成氯酸根離子、陰極上氫離子放電生成氫氣;
②兩種化合物相互交換成分生成另外的兩種化合物的反應為復分解反應,相同溫度下,溶解度小的物質先析出;
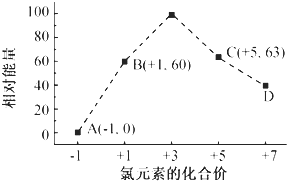
(4)①D微粒中Cl元素化合價為+7,結合離子所帶電荷等于各元素化合價之和計算;
②B→A+C發生反應:3ClO-=ClO3-+2Cl-,反應熱△H=生成物總能量-反應物總能量,注意離子為溶液狀態,進而書寫熱化學方程式;
解答 解:(1)K+與S2-電子層排布相同,核電荷數越大離子半徑越小,所以離子半徑:K+<S2-;
同一周期自左而右,非金屬性增強,所以非金屬性:N<O;
元素的非金屬性越強,對應最高價氧化物的水化物的酸性越強,氯元素的非金屬性比硫元素強,所以酸性:HClO4>H2SO4;
可說明HF中含氫鍵,沸點最高,則沸點:HF>HCl;
故答案為:<;<;<;>;
(2)a.單質的熔點屬于物理性質,不能比較非金屬性強弱,故a錯誤;
b.Cl2、Br2、I2的氧化性越強,元素的非金屬性越強,故b正確;
c.氫化物越穩定,元素的非金屬性越強,故c正確;
d.氫化物的酸性不能比較非金屬性強弱,如HF屬于弱酸、HCl屬于強酸,為F元素非金屬性強于Cl的,故d錯誤,
故選:bc;
(3)①電解時,陽極上氯離子放電生成氯酸根離子、陰極上氫離子放電生成氫氣,所以反應方程式為1NaCl+3H2O═1NaClO3+3H2↑,
故答案為:1;3;1;3;3H2↑;
②NaClO3轉化為KClO3,說明該反應中兩種物質相互交換離子生成鹽,為復分解反應,相同溫度下,溶解度小的物質先析出,室溫下KClO3在水中的溶解度明顯小于其它晶體,所以先析出KClO3;
故答案為:復分解反應;室溫下KClO3在水中的溶解度明顯小于其它晶體;
(4)①根據圖象知,D中Cl元素化合價為+7價,所以ClOx-中x為4,則D為ClO4-;
故答案為:ClO4-;
②B→A+C發生反應:3 ClO-=ClO3-+2Cl-,根據離子能量可知,反應熱△H=53kJ/mol+2×0kJ/mol-3×60kJ/mol=-117kJ/mol,故反應熱化學方程式為:3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案為:3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
點評 本題以鹵族元素為載體考查了氧化還原反應、熱化學反應、非金屬強弱的判斷方法等知識點,根據物質的性質、原子結構結合元素周期律等知識點來分析解答,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
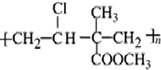 ,其單體為:CH2=CHCl、CH2=C(CH3)COOCH3.
,其單體為:CH2=CHCl、CH2=C(CH3)COOCH3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑與還原劑的物質的量之比為1:6 | |
| B. | 氧化產物與還原產物的質量之比為1:1 | |
| C. | 生成3mol水時有1mol KIO3被氧化 | |
| D. | 1mol KIO3參加反應時有5mol電子轉移 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
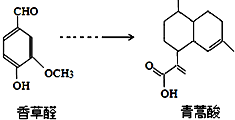
| A. | 青蒿酸分子中含有4個手性碳原子 | |
| B. | 在一定條件,香草醛可與HCHO發生縮聚反應 | |
| C. | 兩種物質分別和H2反應,最多消耗H24mol和3mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鑒別化合物香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HF、HCl、HBr、HI的熔點沸點依次升高 | |
| B. | HF、HCl、HBr、HI水溶液的酸性依次升高 | |
| C. | 乙醇易溶于水,是因為乙醇分子與水分子之間只存在范德華力 | |
| D. | 氯的各種含氧酸的酸性由強到弱排列為HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 森林遇到亂砍濫伐,破壞了生態平衡 | |
| B. | 工業上大量燃燒含硫燃料 | |
| C. | 硫酸廠排出的大量氣體 | |
| D. | 大氣中CO2的含量增多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com