

 .
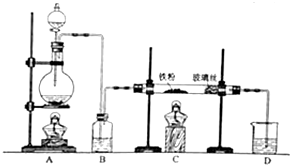
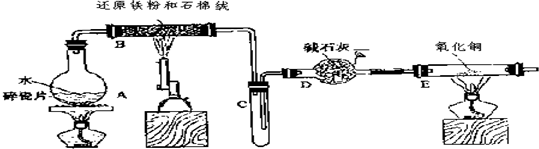
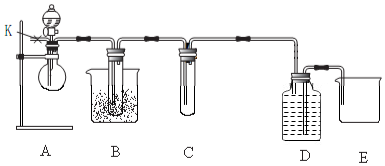
. 分析 (1)儀器A的名稱是圓底燒瓶,B中是鐵與水蒸氣反應生成氫氣和四氧化三鐵;
(2)E是氫氣還原氧化銅的實驗,氣體進入E裝置前要干燥,否則會有危險,硬質玻璃管可能炸裂;
(3)根據氫氣還原氧化銅得到銅和水進行分析;
(4)該反應中Cu元素化合價由+2價變為0價、H元素化合價由0價變為+1價,轉移電子數目為2,得電子化合價降低的反應物是氧化劑、失電子化合價升高的反應物是還原劑.
解答 解:(1)儀器A的名稱是圓底燒瓶,B中是鐵與水蒸氣反應生成氫氣和四氧化三鐵,方程式為:3Fe+4H2O(g)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2,
故答案為:圓底燒瓶; 3Fe+4H2O(g)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;
(2)E是氫氣還原氧化銅的實驗,氣體進入E裝置前要干燥,否則會有危險,硬質玻璃管可能炸裂,
故答案為:干燥氫氫(或除掉氫氣中的水蒸氣);
(3)氫氣還原氧化銅得到銅和水即H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,所以硬質玻璃管中黑色固體變為紅色,硬質玻璃管右端管壁有液滴生成,
故答案為:硬質玻璃管中黑色固體變為紅色,硬質玻璃管右端管壁有液滴生成;
(4)H2還原CuO的方程式和電子轉移的數目和方向, ,
,
故答案為: .
.
點評 本題考查了鐵與水蒸氣反應方程式的書寫,利用氫氣還原氧化銅這個實驗對產物氫氣進行檢驗,考查了實驗操作中的注意事項,題目較簡單.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗目的 |
| A. | 可逆反應FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它條件不變時,加入KCl固體,觀察體系顏色的變化. | 驗證濃度對化學平衡的影響 |
| B. | 相同溫度下,將等質量的大理石塊、大理石粉末分別加入等體積、等濃度的鹽酸和硫酸中,觀察氣泡產生的快慢. | 驗證固體接觸面積對化學反應速率的影響 |
| C. | 相同溫度下,兩只試管中裝有等體積、等濃度的H2O2溶液,向其中分別加入少量FeCl3固體和少量MnO2固體. | 驗證不同催化劑對H2O2分解速率的影響 |
| D. | 將SO2氣體通入溴水中,觀察溶液顏色的變化 | 證明SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 回答下列問題:
回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 FeCl3•6H2O晶體
FeCl3•6H2O晶體查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)將4molSO2和2molO2充入2L的密閉容器中,在一定條件下發生反應,經10s后達到平衡,測得SO3的濃度為0.6mol•L-1,請回答下列問題:
(1)將4molSO2和2molO2充入2L的密閉容器中,在一定條件下發生反應,經10s后達到平衡,測得SO3的濃度為0.6mol•L-1,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe3O4 | Fe2O3 | Fe | |
| 分解溫度/°C | 1538 | 1400 | - |
| 熔點/°C | - | - | 1535 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com