
| Fe3O4 | Fe2O3 | Fe | |
| 分解溫度/°C | 1538 | 1400 | - |
| 熔點/°C | - | - | 1535 |
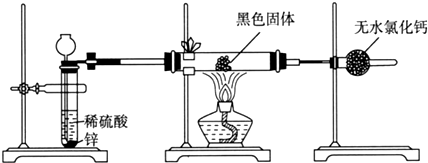
分析 (1)根據Fe的熔點及兩種氧化物的分解溫度確定黑色物質的成分;
(2)根據反應前后黑色固體與硬質玻璃管總質量的差值即為Fe與O2反應消耗O2的質量來判斷;
(3)當鐵元素恰好完全沉淀時,溶液中剩余的溶質為NaCl,據此化學式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),據此計算.
解答 解:(1)根據Fe的熔點及兩種氧化物的分解溫度可知Fe熔化的溫度下,Fe2O3已分解,不可能存在于黑色物質中.驗證黑色物質中是否存在Fe應利用Fe與Fe3O4的不同,酸液中,Fe3O4會生成Fe3+,將可能存在的Fe氧化為Fe2+,不放出氣體,而Fe與Fe3O4 都有磁性,都能被磁鐵吸引,Fe3O4也具有磁性,能被磁鐵吸引,方案3不可取.故答案為:Fe和Fe3O4;黑色固體中Fe含量很少,同時在溶液中發生反應:2Fe3++Fe=3Fe2+,則方案1看不到明顯現象;
(2)反應前后黑色固體與硬質玻璃管總質量的差值即為Fe與O2反應消耗O2的質量,為:m1-m2,根據反,3Fe+2O2$\frac{\underline{\;點燃\;}}{\;}$Fe3O4,從而可以求出原黑色固體中Fe3O4的質量是$\frac{29(m1-m2)}{8}$g,質量分數是$\frac{29(m1-m2)}{8(m2-m3)}$×100%=,故答案為:②③⑤;$\frac{29(m1-m2)}{8(m2-m3)}$;
(3)當鐵元素恰好完全沉淀時,溶液中剩余的溶質為NaCl,據此化學式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),即0.1 L×1.5 mol/L=1 mol/L×V(NaOH),解得:V(NaOH)=0.15 L.故選C.
點評 本題是一道關于鐵元素以及化合物性質實驗方案設計的考查題,注意知識的歸納和梳理是關鍵,難度不大.


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
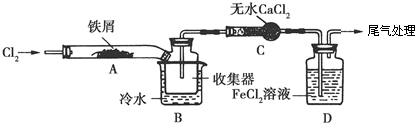
 .FeCl3是共價化合物(填“離子”或“共價”).
.FeCl3是共價化合物(填“離子”或“共價”).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 圖是實驗室制乙酸乙酯的裝置.
圖是實驗室制乙酸乙酯的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室制備乙酸乙酯,是將3mL乙醇加入一支試管中,然后邊振蕩試管,邊慢慢加入2mL濃H2SO4和2mL乙酸,按如圖連接好裝置,在酒精燈上加熱.觀察現象.
實驗室制備乙酸乙酯,是將3mL乙醇加入一支試管中,然后邊振蕩試管,邊慢慢加入2mL濃H2SO4和2mL乙酸,按如圖連接好裝置,在酒精燈上加熱.觀察現象.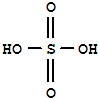 )溶于乙醇中并不是簡單的物理溶解而是伴隨著化學反應,生成了硫酸乙酯(
)溶于乙醇中并不是簡單的物理溶解而是伴隨著化學反應,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(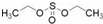 ).
).查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
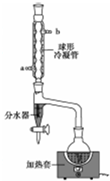 乙酸正丁酯是一種水果香味的無色透明液體,常用于調制香料和藥物.實驗室用正丁醇和乙酸制備,反應原理如下:
乙酸正丁酯是一種水果香味的無色透明液體,常用于調制香料和藥物.實驗室用正丁醇和乙酸制備,反應原理如下:| 物質名稱 | 沸點/℃ | 熔點/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
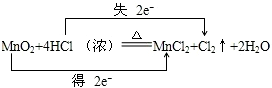 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com