
【題目】閃鋅精礦(含有ZnS、SiO2和少量FeS雜質),鈦白廢液(含H2SO4約20%,還有少量Fe2+、TiO2+)。利用鈦白廢液及閃鋅精礦聯合生產七水合硫酸鋅流程簡化如下:

回答下列問題:
(1)在焙燒過程中,產生了具有漂白性的氣體和金屬氧化物,其中氣體是_________,濾渣X的主要成分是_________________。
(2)氧化時,如果鼓入空氣不足,其弊端是__________,生成H2TiO3的相關離子反應方程式為____________,從生產實際考慮,調pH時,選擇加入石灰乳而不是燒堿的原因是_________。
(3)常溫下,濾液Y中鋅離子濃度約為6mol/L,若Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=6.0×10-18。據此分析,加入石灰乳調節的pH應不超過________,此時溶液中還有的雜質陽離子為H+和__________。
(4)工業上,常用電解硫酸四氨合鋅(II)溶液(含[Zn(NH3)4]2+)制備單質鋅,其陰極的電極反應式為__________。
【答案】SO2(或二氧化硫) SiO2(或二氧化硅) Fe2+氧化不完全,在調節pH時不能除盡Fe2+ 2H2O+TiO2+=H2TiO3↓+2H+或TiO2++Ca(OH)2=H2TiO3+Ca2+ Ca(OH)2來源廣,價格便宜 5 Ca2+ [Zn(NH3)4]2++2e-=Zn+4NH3
【解析】
閃鋅精礦焙燒過程中ZnS和FeS會與O2反應,生成金屬氧化物和SO2,加入鈦白廢液,金屬氧化物會與鈦白廢液中的H2SO4反應,生成溶于水的硫酸鹽。過濾,不溶于酸的SiO2被除去。通過空氣氧化Fe2+成Fe3+,加入石灰乳調節pH,以便轉化為Fe(OH)3沉淀除去,TiO2+也轉化為H2TiO3沉淀除去,過濾得到ZnSO4溶液,最后得到ZnSO4·7H2O。
(1)由信息可知,焙燒過中發生反應:2ZnS+3O2 ![]() 2ZnO+2SO2,4FeS+7O2
2ZnO+2SO2,4FeS+7O2![]() 2Fe2O3+4SO2,所以放出的氣體是SO2;由于ZnO和Fe2O3均溶于硫酸,SiO2不溶于H2SO4,因此濾渣X為SiO2;
2Fe2O3+4SO2,所以放出的氣體是SO2;由于ZnO和Fe2O3均溶于硫酸,SiO2不溶于H2SO4,因此濾渣X為SiO2;
(2)通入空氣的目的是為了將Fe2+氧化為Fe3+從而形成Fe(OH)3除去,如果空氣不足,Fe2+沒有被完全氧化,在調節pH時,不能完全除去Fe2+;
加入石灰乳調節pH,TiO2+轉化為H2TiO3,分析化合價可知,Ti的化合價沒有發生變化,根據原子守恒配平,則化學方程式為2H2O+TiO2+=H2TiO3↓+2H+或TiO2++Ca(OH)2=H2TiO3+Ca2+;
生產實際考慮時,必須考慮原料的來源和價格,石灰乳Ca(OH)2來源廣,價格便宜;
(3)調節pH時,Fe3+要沉淀完全,而Zn2+不能沉淀,假設Fe3+沉淀完全的濃度為1×10-5mol·L-1,c(Fe3+)3c(OH-)= Ksp[Fe(OH)3]=4.0×10-38,可求出c(OH-)=1.6×10-11mol·L-1;當Zn2+恰好沉淀時,c(Zn2+)2c(OH-)= Ksp[Zn(OH)2]=6.0×10-18,c(Zn2+)=6mol/L,可求出c(OH-)=10-9mol·L-1,則c(OH-)不應超過10-9mol·L-1,可計算最大的pH值,![]() ,因此pH應不超過5;
,因此pH應不超過5;
加入石灰乳Ca(OH)2調節pH時,生成的CaSO4是微溶物,因此濾液中還會有Ca2+;
(4)根據信息,由[Zn(NH3)4]2+制備Zn,在陰極,得電子發生還原反應,則電極反應為[Zn(NH3)4]2++2e-=Zn+4NH3。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】將2molSO2和1molO2混合置于體積可變,壓強恒定的密閉容器中,在一定溫度下發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,當反應進行到時間t1點時達到平衡狀態,測得混合氣體總物質的量為2.1mol.試回答下列問題:
2SO3(g) △H<0,當反應進行到時間t1點時達到平衡狀態,測得混合氣體總物質的量為2.1mol.試回答下列問題:
(1)若平衡時,容器體積為aL,寫出該反應的平衡常數為:K=__________(用含a的代數式表示)
(2)反應進行到t1時,SO2的體積分數為_______________;
(3)若在t1時充入一定量的氬氣(Ar),SO2的物質的量將________(填“增大”、“減小”或“不變”);
(4)若在t1時升溫,重新達到平衡狀態,新平衡混合物中氣體的總物質的量____2.1mol(填“<”、“>”或“=”),簡單說明原因:____________。
(5)若t1達到平衡后,保持容器的體積不再變化。再加入0.2molSO2、0.1molO2和1.8molSO3,此時v逆________v正 (填“<”、“>”或“=”)。
(6)一定溫度下,在三個容積相同的恒容密閉容器中按不同方式投入反應物,發生反應2SO2(g)+O2(g)![]() 2SO3(g)(正反應放熱),測得反應的相關數據如下:
2SO3(g)(正反應放熱),測得反應的相關數據如下:
容器1 | 容器2 | 容器3 | |
反應溫度T/K | 700 | 700 | 800 |
反應物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡體系總壓強p/Pa | p1 | p2 | p3 |
物質的平衡轉化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常數K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列橫線上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環氧樹脂因其具有良好的機械性能、絕緣性能以及與各種材料的粘結性能,已廣泛應用于涂料和膠黏劑等領域。下面是制備一種新型環氧樹脂G的合成路線:
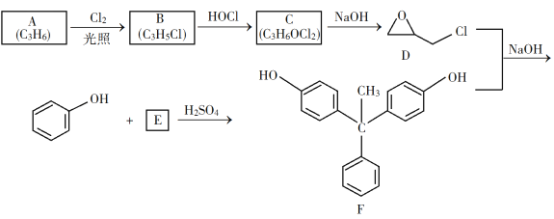

已知以下信息:
①
② ③
③
回答下列問題:
(1)A是一種烯烴,化學名稱為__________,C中官能團的名稱為_________、_________。
(2)由B生成C的反應類型為_________。
(3)由C生成D的反應方程式為__________________。
(4)E的結構簡式為__________________。
(5)E的二氯代物有多種同分異構體,請寫出其中能同時滿足以下條件的芳香化合物的結構簡式__________、_________。
①能發生銀鏡反應;②核磁共振氫譜有三組峰,且峰面積比為3∶2∶1。
(6)假設化合物D、F和![]() 恰好完全反應生成
恰好完全反應生成![]() 單一聚合度的G,若生成的
單一聚合度的G,若生成的![]() 和
和![]() 的總質量為
的總質量為![]() ,則G的n值理論上應等于__________。
,則G的n值理論上應等于__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家合成出了一種新化合物(如圖所示),其中W、X、Y、Z為同一短周期元素,Z核外最外層電子數是X核外電子數的一半。下列敘述正確的是

A. WZ的水溶液呈堿性
B. 元素非金屬性的順序為X>Y>Z
C. Y的最高價氧化物的水化物是中強酸
D. 該新化合物中Y不滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鹽酸中加入少量K2FeO4固體,產生黃綠色氣體。該反應的化學方程式是___。
(2)用NaClO-NaOH溶液氧化AgNO3,制得高純度的納米級Ag2O2。寫出該反應的離子方程式:___。
(3)為實現燃煤脫硫,向煤中加入漿狀Mg(OH)2,使燃燒產生的SO2轉化為穩定的Mg化合物,寫出該反應的化學方程式:___。
(4)Cl2與熱的NaOH溶液反應生成NaClO3,該反應的離子方程式為___。
(5)在酸性條件下,NaHSO3使Cr2O72-還原成為Cr3+,寫出該反應的離子方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CaC2晶體的晶胞結構與NaCl晶體的相似(如圖所示),但CaC2晶體中含有啞鈴形的![]() ,使晶胞沿一個方向拉長。下列關于CaC2晶體的說法正確的是( )
,使晶胞沿一個方向拉長。下列關于CaC2晶體的說法正確的是( )
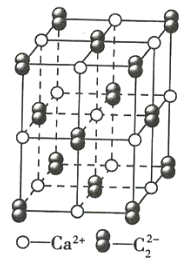
A.每個Ca2+周圍距離最近且相等的![]() 的數目為6
的數目為6
B.該晶體中的陰離子與F2是等電子體
C.6.4g CaC2晶體中含有0.1mol陰離子
D.每個Ca2+周圍距離最近且相等的Ca2+有12個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關苯分子的說法不正確的是( )
A.苯分子中![]() 原子采用
原子采用![]() 雜化,形成夾角為
雜化,形成夾角為![]() 的三個
的三個![]() 雜化軌道
雜化軌道
B.每個碳原子有一個與碳環平面垂直的未參與雜化的![]() 軌道,以“肩并肩”方式相互重疊,形成大
軌道,以“肩并肩”方式相互重疊,形成大![]() 鍵
鍵
C.苯分子中最多有六個原子共面,六個碳碳鍵完全相同
D.苯分子中的大![]() 鍵可表示為
鍵可表示為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示NaCl晶胞,直線交點處的圓圈為Na+或Cl-所處的位置。這兩種離子在空間三個互相垂直的方向上都是等距離排列的。

(1)請將其中代表Cl-的圓圈涂黑(不必考慮離子半徑大小),以完成NaCl晶胞示意圖。_____________
(2)晶體中,在每個Na+的周圍與它最近且距離相等的Na+共有_______個。
(3)一個NaCl晶胞中Cl-的個數等于_______,即______________(填計算式);Na+的個數等于_______,即______________(填計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6種元素的代號。其中J為0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列說法正確的是( )
A.基態R原子的軌道表示式為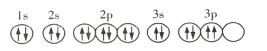
B.![]() 與
與![]() 的半徑大小關系為
的半徑大小關系為![]()
C.Y的第一電離能大于X的第一電離能
D.X、Y、Z、R、W中,電負性最大的元素為W
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com