
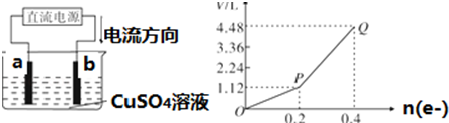
分析 (1)由圖可知,電流由正極流向負極,則b為陽極,a為陰極,發生電極反應:Cu2++2e-=Cu,2H++2e-=H2↑,據此回答;
(2)a為陰極,發生電極反應:Cu2++2e-=Cu,2H++2e-=H2↑,據此回答;
(3)到Q點時收集到的混合氣體為氫氣和氧氣,由電解水反應可知0.2mol電子通過時生成0.1molH2、0.05molO2,據M=$\frac{m}{n}$計算;
(4)①根據電解池的工作原理,要想讓電解后的電解質復原,則遵循的原則是:出什么加什么,加入 Cu(OH)2后溶液與電解前相同,則銅離子和氫氧根放電;
②電解硫酸銅溶液后溶液呈酸性,向電解后的溶液中加入堿式碳酸銅能恢復原溶液,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳,溶液質量增加的量是銅、氫氧根離子,所以實際上電解硫酸銅溶液分兩個階段:第一階段2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,第二階段:2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,將堿式碳酸銅化學式改變為2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相當于加入0.2molCuO和0.1mol水,根據氧化銅和水的量計算即可.
解答 解:(1)由圖可知,電流由正極流向負極,則b為陽極,a為陰極,惰性電極電解一定量的硫酸銅溶液,發生2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,結合圖2可知,通過0.2mol電子時電解硫酸銅,然后電解硫酸溶液,發生2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,a為陰極,先發生Cu2++2e-=Cu,后發生2H++2e-=H2↑,電極表面的現象是紅色固體物質析出,電解一段時間后放出氣體,故答案為:陽極;紅色固體物質析出,電解一段時間后放出氣體;
(2)a為陰極,先發生Cu2++2e-=Cu,后發生2H++2e-=H2↑,故答案為:Cu2++2e-=Cu,2H++2e-=H2↑;
(3)到Q點時收集到的混合氣體為氫氣和氧氣,由電解水反應可知0.2mol電子通過時生成0.1molH2、0.05molO2,則混合氣體的平均摩爾質量為$\frac{0.1×2+0.05×32}{0.1+0.05}$g/mol=12g•mol-1,故答案為:12;
(4)①由信息可知,電解發生2H2O+2CuSO4$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4 ,向所得溶液中加入0.8g即$\frac{0.8g}{80g/mol}$=0.01mol CuO充分反應后,溶液恰好恢復到電解前的狀態,則電解中生成0.01molCu,同時生成0.01molH2SO4,所以電解后溶液的C(H+)=$\frac{0.01×2mol}{0.2L}$=0.1mol/L,pH=1.
故答案為:1;
②電解硫酸銅溶液后溶液呈酸性,向電解后的溶液中加入堿式碳酸銅能恢復原溶液,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳,溶液質量增加的量是銅、氫氧根離子,所以實際上電解硫酸銅溶液分兩個階段:
第一階段2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,
第二階段:2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,
將堿式碳酸銅化學式改變為2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相當于加入0.2molCuO和0.1mol水,
第一階段:根據銅原子守恒知,電解硫酸銅溶液析出n(Cu)=n(CuO)=0.2mol,轉移電子的物質的量=0.2mol×2=0.4mol;
第二階段:電解生成0.1mol水轉移電子的物質的量=0.1mol×2=0.2mol,
所以電解過程中共轉移的電子數為0.4mol+0.2mol=0.6mol,故答案為:0.6.
點評 本題考查電解原理,明確圖象這電子轉移與生成氣體的關系及離子的放電順序和實際上加入的物質是解答本題的關鍵,再根據原子守恒、轉移電子守恒來分析解答,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 為防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 該反應中氧化劑與還原劑物質的量之比為8:1 | |
| C. | 若有1molNO3-發生氧化反應,則轉移電子5mol | |
| D. | 該反應中Fe2+是還原劑,NH4+是還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H8,C4H6 | B. | C3H6,C4H6O2 | C. | C2H2,C6H6 | D. | CH4O,C2H4O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:K+、Na+、NO3-、CH3COO- | |
| C. | 0.1mol•L-1NH4HCO3溶液:Na+、Fe3+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 1 mol莽草酸完全燃燒消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多與4 mol Na發生反應 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可發生聚合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈紅色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH試紙顯紅色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com