
 .
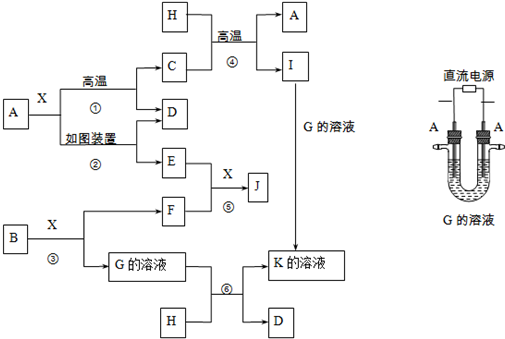
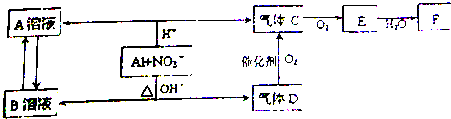
.分析 X常溫下為無色液體,B為淡黃色固體,二者反應生成G與單質,應是過氧化鈉與水反應,故X為H2O,B為B為Na2O2,G為NaOH,F為O2;A既能與水在高溫下反應生成單質D,又可做電極電解氫氧化鈉溶液得到D,且E在氧氣和水的作用下得到J,J溶于酸為黃色溶液,則A為Fe,C為Fe3O4,D為H2,E為Fe(OH)2,J為Fe(OH)3;H既能與氫氧化鈉溶液反應,又能與Fe3O4反應,故H為金屬Al,由此可知I 為Al2O3,K為NaAlO2,結合對應物質的性質以及題目要求可解答該題.
解答 解:X常溫下為無色液體,B為淡黃色固體,二者反應生成G與單質F,應是過氧化鈉與水反應,故X為H2O,B為B為Na2O2,G為NaOH,F為O2;A既能與水在高溫下反應生成單質D,又可做電極電解氫氧化鈉溶液得到D,且E在氧氣和水的作用下得到J,J溶于酸為黃色溶液,則A為Fe,C為Fe3O4,D為H2,E為Fe(OH)2,J為Fe(OH)3;金屬H既能與氫氧化鈉溶液反應,又能與Fe3O4反應,故H為金屬Al,由此可知I為Al2O3,K為NaAlO2.
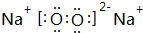
(1)B為Na2O2,電子式為: ,故答案為:
,故答案為: ;
;
(2)用Fe作電極電解NaOH溶液,在電極上生成Fe(OH)2的反應式:Fe+2OH--2e-=Fe(OH)2,
故答案為:Fe+2OH--2e-=Fe(OH)2;
(3)反應①的化學方程式是:3Fe+4H2O $\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2,反應④在生產中有重要應用,被稱為鋁熱反應,實驗室中引發反應④的操作是:加入少量KClO3,在KClO3上插上鎂條并點燃鎂條,
故答案為:3Fe+4H2O $\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;加入少量KClO3,在KClO3上插上鎂條并點燃鎂條;
(4)反應⑥的離子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑.
點評 本題考查無機物推斷,涉及Fe、Al元素化合物性質,側重于學生的分析能力的考查,物質的性質、轉化中特殊反應、鋁熱反應、電解原理等是解題關鍵,需要熟練掌握物質性質,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
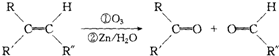
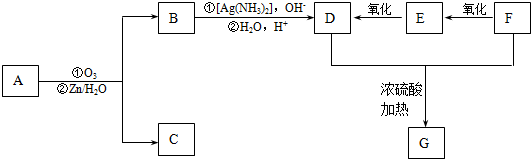
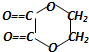 +2H2O,反應類型是酯化反應.D與碳酸氫鈉反應的化學方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反應類型是酯化反應.D與碳酸氫鈉反應的化學方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
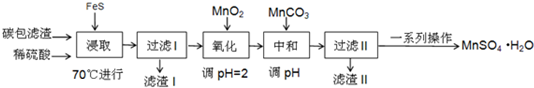
| 物質 | FeS | MnS | HgS |
| 溶度積 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 開始沉淀時的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全時的PH | 8.4 | 3.7 | 9.8 |
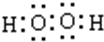 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
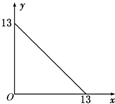 某溫度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x與y的關系如圖所示,請回答下列問題:
某溫度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x與y的關系如圖所示,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
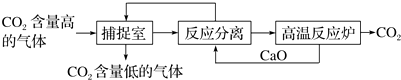
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
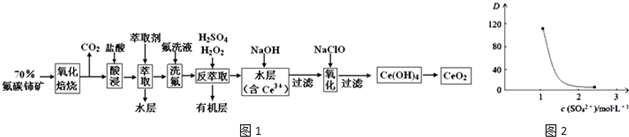
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
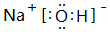 ,該物質和⑤的最高價氧化物對應水化物發生反應的化學反應方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,該物質和⑤的最高價氧化物對應水化物發生反應的化學反應方程式是NaOH+Al(OH)3=NaAlO2+2H2O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可溶性銅鹽有毒,故人體內不存在銅元素 | |
| B. | 硅膠可用作食品干燥劑 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纖維復合而成,是一種新型無機非金屬材料 | |
| D. | 中秋佳節月餅中用小袋包裝的鐵粉來防止月餅氧化變質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com