
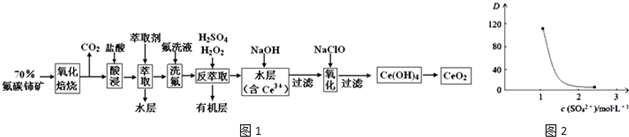
分析 氟碳鈰礦(主要含CeFCO3),“氧化焙燒”的目的是將+3價鈰氧化成+4價,Ce4+能與F-結合成[CeFx](4-x)+,以便后續的提取,加稀硫酸,與SO42-結合成[CeSO4]2+,加萃取劑,氟洗液,硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能,加“反萃取”加H2O2,又將Ce4+還原為Ce3+,發生反應2Ce4++H2O2=2Ce3++O2↑+2H+,加入堿后Ce3+轉化為沉淀,通入氧氣講Ce從+3氧化為+4,得到產品,
(1)氧化焙燒”前需將礦石粉碎成細顆粒是為了增加固體與氧氣接觸面積燃燒充分,增大固體和氧氣的接觸面積,反應更充分;
(2)“酸浸”中會產生大量黃綠色氣體應為氯氣,CeO2與鹽酸發生氧化還原反應生成Ce3+和氯氣,可以用硫酸代替鹽酸而避免產生氯氣污染;
(3)實驗室中萃取時用到的主要玻璃儀器名稱為分液漏斗,根據平衡:Ce4++n(HA)2?Ce•(H2n-4A2n)+4H+,加入Na2SO4時,隨著c(SO42-)增大,水層中Ce4+被SO42-結合成[CeSO4]2+,導致萃取平衡向左移動,D迅速減小;
(4)“反萃取”加H2O2的作用是將Ce4+離子重新還原為Ce3+,反應的離子方程式為2Ce4++H2O2=2Ce3++O2↑+2H+;
(5)“氧化”步驟中用次氯酸鈉將Ce3+氧化成Ce4+,根據元素守恒和電荷守恒書寫離子方程式;
(6)根據電子得失守恒可得關系式CeO2~FeSO4,根據FeSO4的物質的量可計算出CeO2的質量,進而確定產品中CeO2的質量分數;
解答 解:氟碳鈰礦(主要含CeFCO3),“氧化焙燒”的目的是將+3價鈰氧化成+4價,Ce4+能與F-結合成[CeFx](4-x)+,以便后續的提取,加稀硫酸,與SO42-結合成[CeSO4]2+,加萃取劑,氟洗液,硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能,加“反萃取”加H2O2,又將Ce4+還原為Ce3+,發生反應2Ce4++H2O2=2Ce3++O2↑+2H+,加入堿后Ce3+轉化為沉淀,通入氧氣講Ce從+3氧化為+4,得到產品,
(1)“氧化焙燒”前需將礦石粉碎成細顆粒,其目的是增大固體和氧氣的接觸面積,反應更充分,
故答案為:增大固體和氧氣的接觸面積,反應更充分;
(2)“酸浸”中會產生大量黃綠色氣體應為氯氣,CeO2與鹽酸發生氧化還原反應生成Ce3+和氯氣,反應的離子方程式為2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑,可以用硫酸代替鹽酸而避免產生氯氣污染,
故答案為:2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑;用硫酸代替鹽酸;
(3)實驗室中萃取時用到的主要玻璃儀器名稱為分液漏斗,根據平衡:Ce4++n(HA)2?Ce•(H2n-4A2n)+4H+,加入Na2SO4時,隨著c(SO42-)增大,水層中Ce4+被SO42-結合成[CeSO4]2+,導致萃取平衡向左移動,D迅速減小,
故答案為:分液漏斗;隨著c(SO42-)增大,水層中Ce4+被SO42-結合成[CeSO4]2+,導致萃取平衡向左移動,D迅速減小;
(4)“反萃取”加H2O2的作用是將Ce4+離子重新還原為Ce3+,反應的離子方程式為2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在該反應中作還原劑,每有1mol H2O2參加反應,轉移電子的物質的量為2mol,
故答案為:還原劑;2mol;
(5)“氧化”步驟中用次氯酸鈉將Ce3+氧化成Ce4+,反應的離子方程式為2Ce32Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl,
故答案為:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(6)FeSO4的物質的量為0.1000mol•L-1×0.025L=0.0025mol,根據電子得失守恒可得關系式CeO2~FeSO4,所以CeO2的質量為0.0025×172g=0.4300g,產品中CeO2的質量分數為$\frac{0.4300g}{0.4500g}$×100%=95.60%,
故答案為:95.60%.
點評 本題考查物質分離和提純,為高頻考點,涉及物質分離和提純方法選取、氧化還原反應等知識點,明確反應原理是解本題關鍵,知道流程圖中發生的反應及基本操作方法,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | ||||||
| Y | Z | W |
| A. | 工業上電解ZW3飽和溶液冶煉金屬Z | |
| B. | 元素X的最高正價與W的最高正價相同 | |
| C. | 簡單離子半徑的大小順序:r(X-)<r(Y+) | |
| D. | Y、W的最高價氧化物的水化物均能溶解金屬Z |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗.
某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol 鈉與氧氣反應生成 Na2O 或 Na2O2時,失電子數目均為 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+數目為 NA | |
| C. | 標準狀況下,2.24LC6H6 所含的分子數目為 0.1NA | |
| D. | 1 mol Na2O2 中含有的陰離子數目為 2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫元素既被氧化又被還原 | |
| B. | 氧化劑與還原劑的物質的量之比為1:2 | |
| C. | 每生成1molNa2S2O3,轉移4mol電子 | |
| D. | 相同條件下,每吸收10m3SO2就會放出5m3CO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com