
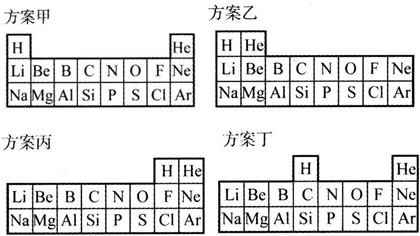
| “合理”的理由 | |
| 方案甲 | |
| 方案乙 | |
| 方案丙 | |
| 方案丁 |
分析 (1)甲是根據其最外層電子數及最外層電子數是否達到穩定結構判斷;
乙是根據其原子最外層電子數排列;
丙是根據得失電子數判斷;
丁是根據最外層電子數判斷;
(2)方案丙中把H放在第ⅦA族是因為氫也可得到一個電子形成穩定結構,從而顯-1價;
(3)方案丁中H和C、Si一樣形成化合物時最高正化合價等于最低負化合價的絕對值;
(4)最外層電子數為1的短周期元素可以為非金屬元素H,也可以是金屬元素Li、Na等;最外層電子數為2的短周期元素可以為稀有氣體元素He,也可以是金屬元素Be、Mg等.
解答 解:(1)甲中H與Li、Na等第ⅠA族元素的原子最外層均有一個電子,He與Ne、Ar等稀有氣體元素的原子最外層都已達穩定結構;
乙中He與Be、Mg等第ⅡA族元素的原子最外層電子數均為2;
丙中H與F、Cl等第ⅦA族元素的原子均可得一個電子形成穩定結構;
丁中H與C、Si等第ⅣA族的非金屬元素原子都不易得到或失去電子形成穩定結構,
故答案為:
| “合理”的理由 | |
| 方案甲 | H與Li、Na等第ⅠA族元素的原子最外層均有一個電子,He與Ne、Ar等稀有氣體元素的原子最外層都已達穩定結構 |
| 方案乙 | He與Be、Mg等第ⅡA族元素的原子最外層電子數均為2 |
| 方案丙 | H與F、Cl等第ⅦA族元素的原子均可得一個電子形成穩定結構 |
| 方案丁 | H與C、Si等第ⅣA族的非金屬元素原子都不易得到或失去電子形成穩定結構 |
點評 本題考查元素周期表結構及元素排列,為高頻考點,側重考查學生分析總結歸納能力,根據原子核外電子排布特點來分析解答,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{a}{288V}$mol/L | B. | $\frac{125a}{36V}$mol/L | C. | $\frac{125a}{18V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C60能溶于二硫化碳中形成無色透明的溶液,可以用相似相溶原理解釋 | |
| B. | 向含有Fe2+的溶液中滴加無色的鐵氰化鉀溶液,可以觀察到藍色沉淀產生 | |
| C. | 甲烷是空間正四面體結構,四個氫的相對位置完全等效,其任意取代物都不會產生同分異構現象 | |
| D. | 電子云是處于一定空間運動狀態的電子在原子核外空間的概率密度分布的形象化描述 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
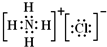 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 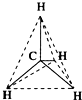 結構示意圖 | B. |  電子式 | C. | 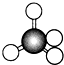 球棍模型 | D. | 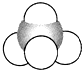 比例模型 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 [Cu(NH3)4]SO4•H2O是一種殺蟲劑.
[Cu(NH3)4]SO4•H2O是一種殺蟲劑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100mL12mol/L濃鹽酸與足量的MnO2加熱充分反應生成氯氣分子數為0.3 NA | |
| B. | 5.6 g鐵粉與硝酸反應失去的電子數一定為0.3NA | |
| C. | 向FeI2溶液中通入適量Cl2,當有1 mol Fe2+被氧化時,共轉移的電子的數目為NA | |
| D. | 5.4g鋁粉與足量的氫氧化鈉溶液充分反應生成氫氣分子數為0.3 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com