
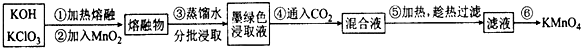
分析 氫氧化鉀和氯酸鉀加熱熔融加入二氧化錳得到熔融物,加入蒸餾水得到墨綠色浸取液,通入二氧化碳發生反應生成KMnO4和MnO2和碳酸鹽,加熱成熱過濾得到濾液,濾液加熱濃縮至液面有細小晶體析出時,停止加熱,冷卻結晶、過濾、洗滌、干燥,干燥過程中,溫度不宜過高得到高錳酸鉀,
(1)熔融固體需要用鐵坩堝熔融,瓷坩堝原料含有SiO2,能和堿反應,高溫下與KOH發生反應;
(2)由題意可知,KOH、KClO3、MnO2共熔制得綠色K2MnO4,CO2使MnO42-發生歧化反應,生成MnO4-和MnO2;
(3)KMnO4在加熱的條件下會發生分解反應;
(4)向H2O2溶液中滴加酸性高錳酸鉀溶液.則酸性高錳酸鉀溶液會褪色說明高錳酸鉀做氧化劑氧化過氧化氫為氧氣,依據電子守恒和原子守恒分析配平書寫離子方程式;依據氧化還原反應中定量關系計算;
(5)根據SO2和Cl2的化學性質分析反應現象,從而判斷反應現象是否相同;
(6)設碘元素在氧化產物中的化合價為a,則根據電子轉移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得:a=+5,所以碘單質被氧化為HIO3,據此書寫方程式;
(7)以NaOH溶液吸收尾氣,NaOH溶液一定過量,SO2和NaOH反應產生亞硫酸鈉,亞硫酸鈉易被空氣中的氧氣氧化生成硫酸鈉.
解答 解:Ⅰ.(1)由于KOH是強堿,在加熱及高溫時容易與玻璃、陶瓷中的SiO2發生反應,該反應的方程式為:SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O.所以加熱熔融KClO3和KOH的混合物應在鐵坩堝中進行,故答案為:SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O;
(2)KOH、KClO3、MnO2共熔制得綠色K2MnO4,CO2使MnO42-發生歧化反應,生成MnO4-和MnO2,根據題意結合原子守恒和電荷守恒,可得該反應的方程式為:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,故答案為:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;
(3)第⑥步加熱濃縮至液面有細小晶體析出時.停止加熱.冷卻結晶、過濾、洗滌、干燥.KMnO4受熱容易發生分解反應:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.為了防止KMnO4的分解,所以在干燥時溫度不宜過高,故答案為:防止溫度過高,KMn04受熱分解;
(4)KMnO4和H2O2都有強的氧化性,但KMnO4的氧化性更強,所以二者發生反應時H2O2作還原劑,把KMnO4還原為無色的Mn2+,而使溶液褪色,2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,氧化產物與還原產物的物質的量之比為5:2,故答案為:5:2;
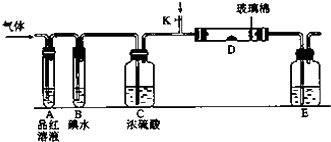
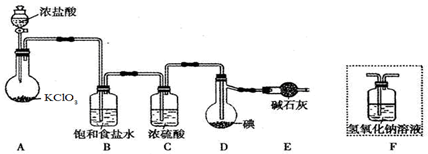
Ⅱ.(5)二氧化硫能和有色物質反應生成無色物質,所以二氧化硫有漂白性;氯氣和水反應生成次氯酸,次氯酸具有強氧化性,能使有色物質褪色,所以若從左端分別通入SO2和Cl2,裝置A中觀察到的現象相同,都使品紅褪色,故答案為:相同;
(6)裝置B中裝有5.0mL1.0mol•L-1的碘水,當通入足量Cl2完全反應后,共轉移了5.0×10-2mol電子,故I元素在氧化產物中的化合價為5.0×10-2/(0.005×1.0)=5,故氧化產物為HIO3,氯氣被還原為HCl,反應方程式為:5Cl2+I2+6H2O=10HCl+2HIO3 ,故答案為:5Cl2+I2+6H2O=10HCl+2HIO3 ;
(7)以NaOH溶液吸收尾氣,NaOH溶液一定過量,SO2和NaOH反應產生亞硫酸鈉,亞硫酸鈉易被空氣中的氧氣氧化生成硫酸鈉,所以實驗結束后,E裝置中可能含有的溶質為NaOH、Na2SO3、Na2SO4,故答案為:NaOH、Na2SO3、Na2SO4.
點評 本題考查學生對工藝流程的理解、閱讀獲取信息能力、物質推斷、氧化還原反應、工藝條件的控制等,題目難度中等,是對所學知識的綜合運用與能力的考查,需要學生具備扎實的基礎知識與綜合運用知識、信息進行解決問題的能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鋁片與鹽酸反應生成氫氣 | B. | 氫氧化鋁溶于強堿溶液 | ||
| C. | 氫氧化鋁溶于強酸溶液 | D. | 鋁熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 制備方法 | 具體內容 |
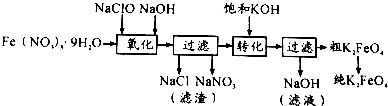
| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鉀和KNO2等產物 |
| 濕法 | 強堿性介質中,Fe(NO3)3與KClO反應生成紫紅色高鐵酸鉀溶液 |
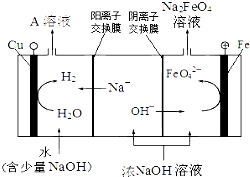
| 電解法 | 電解濃NaOH溶液制備Na2FeO4 |
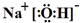 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
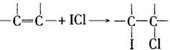
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
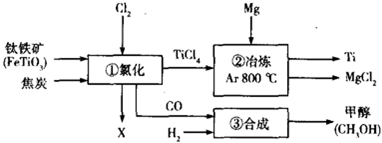
 .
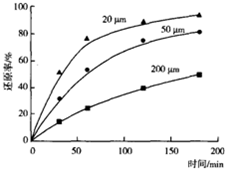
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應速率主要取決于反應②的快慢 | B. | 反應速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是該反應的催化劑 | D. | 該反應的焓變等于akJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com