
分析 (1)MnO2與濃鹽酸在加熱條件下發生氧化還原反應生成氯氣;反應中Mn元素化合價由+4價降低到+2價,Cl元素化合價由-1價升高為0價,反應中消耗4mol氯化氫,只有2mol氯化氫中氯元素化合價升高,被氧化,據此計算被氧化的HCl的物質的量;
(2)鋁和氫氧化鋇溶液反應生成偏鋁酸鋇和氫氣,偏鋁酸鋇易溶于水易電離;
(3)氫氧化亞鐵在氧氣和水的作用下生成氫氧化鐵,就是氫氧化亞鐵與氧氣和水發生反應的過程,據此寫出化學方程式;
(4)硅酸鈉的水溶液俗稱水玻璃,向其中通入過量的CO2,會出現軟而透明的凝膠膠體硅酸膠體和一種鈉鹽,該鈉鹽為碳酸氫鈉.
解答 解:(1)MnO2與濃鹽酸在加熱條件下發生氧化還原反應生成氯氣,方程式為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反應中消耗4mol氯化氫,只有2mol氯化氫中氯元素化合價升高,被氧化,氯元素由-1價升高到0價,所以如有1mol Cl2生成,被氧化的HCl的物質的量是2mol轉移電子數為2mol,
故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2mol;
(2)鋁和氫氧化鋇溶液反應生成偏鋁酸鋇,反應的化學方程式為:2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑,反應的離子方程式為:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案為:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)氫氧化亞鐵與氧氣和水發生反應生成氫氧化鐵,反應為:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案為:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)硅酸鈉的水溶液俗稱水玻璃,向其中通入過量的CO2,會出現軟而透明的凝膠膠體硅酸膠體和碳酸氫鈉,其離子方程式是:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案為:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
點評 本題考查了方程式的書寫方法和注意問題,掌握物質的性質和反應原理是方程式的書寫關鍵,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題

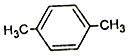 D.
D.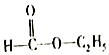
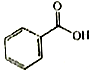 F.
F. 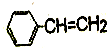 G.
G.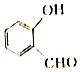
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 因為河蝦中含有砷元素,所以不能食用 | |
| B. | “兩者同食”發生的反應中維生素C作氧化劑 | |
| C. | 五價砷在維生素C作用下發生了還原反應 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推測所含的砷元素化合價為+5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1mol Na與足量O2反應,生成Na2O和Na2O2 的混合物,鈉失去電子數為NA | |
| B. | 常溫常壓下,32gO2 和O3 的混合氣體所含原子數為2NA | |
| C. | 22.4LCl2含有的原子數為2NA | |
| D. | 標準狀況下,1molFe與22.4LCl2充分反應,轉移電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性氧化物都是非金屬氧化物 | |
| B. | 乙醇和二甲醚分子式相同,結構不同,互為同素異形體 | |
| C. | 丁達爾效應可用于區別溶液與膠體 | |
| D. | 熔融狀態能導電的物質一定是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體一定是均一、透明、介穩的 | B. | 用丁達爾效應區別膠體和溶液 | ||
| C. | 可以用濾紙來分離膠體和溶液 | D. | 膠體只能在液體中形成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com