
分析 (1)設出FeO、Fe2O3的物質的量,然后根據“鐵、氧的物質的量之比為4:5”列式計算出二者的物質的量之比,然后計算出二價鐵與三價鐵的物質的量之比;
(2)根據“二價鐵與三價鐵的物質的量之比為1:2”計算出FeO、Fe2O3的物質的量物質的量之比,然后計算出該催化劑中鐵的質量分數;
(3)根據n=$\frac{m}{M}$計算320g Fe2O3 的物質的量,再根據當催化劑中Fe2+與Fe3+的物質的量之比為1:2時,其催化劑活性最高,計算FeO 的物質的量,根據方程式 計算碳的物質的量、生成二氧化碳的物質的量,根據m=nM計算碳粉質量,根據V=nVm計算二氧化碳體積.
解答 解:(1)設FeO、Fe2O3的物質的量分別為x、y,鐵、氧的物質的量之比為4:5,則(x+2y):(x+3y)=4:5,整理可得x:y=2:1,則二價鐵與三價鐵的物質的量之比為(2×1):(1×2)=1:1,
故答案為:1:1;
(2)當催化劑中二價鐵與三價鐵的物質的量之比為1:2時,FeO、Fe2O3的物質的量物質的量之比=1:(2×$\frac{1}{2}$)=1:1,則該催化劑中鐵的質量分數為:$\frac{56×(1+2)}{72+160}$≈0.072,
故答案為:0.72;
(3)320g Fe2O3 的物質的量為:$\frac{320g}{160g/mol}$=2mol,根據當催化劑中Fe2+與Fe3+的物質的量之比為1:2時,其催化劑活性最高,則FeO為2mol×2×$\frac{1}{3}$=$\frac{4}{3}$mol,
2Fe2O3+C$\stackrel{高溫}{→}$4FeO+CO2↑
1 4 1
n(C) $\frac{4}{3}$mol n(CO2)
n(C)=n(CO2)=$\frac{\frac{4}{3}mol×1}{4}$=$\frac{1}{3}$mol,
故m(C)=$\frac{1}{3}$mol×12g/mol=4g,
該條件下V(CO2)=$\frac{1}{3}$mol×24gL/mol=8L
故答案為:4;8L.
點評 本題考查物質的量的計算、混合物計算,屬于拼合型題目,側重考查學生分析解決問題的能力,注意掌握物質的量與氣體摩爾體積、摩爾質量等之間的關系.


 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案科目:高中化學 來源: 題型:選擇題
| A. | 濃的強酸和稀的強堿反應 | B. | 濃的弱酸和稀的強堿反應 | ||
| C. | 等濃度的強酸和弱堿反應 | D. | 稀的強酸和濃的弱堿反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某酸性溶液中可能大量存在:NH4+、Fe3+、NO3-、I- | |
| B. | 由水電離的c(H+)=10-12 mol•L-1的溶液中,Al3+、Cl-、Ba2+、NO3-一定不能大量共存 | |
| C. | 向NH3•H2O溶液中滴加少量AlCl3溶液,發生反應:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向含有1 mol FeBr2的水溶液中通入標準狀況下11.2 L Cl2,發生反應:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
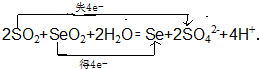 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,32g03含有的氧原子數為2NA | |
| B. | 常溫常壓下,22.4LCH4含有的分子數為NA | |
| C. | 1Llmol•L-1CaCl2溶液中含有的Cl-數為NA | |
| D. | 1molZn變為Zn2+時失去的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl=Na++Cl- | B. | H2SO4=2H++SO42- | ||
| C. | Ca(OH)2=Ca2++2OH- | D. | Al2(SO4)3=Al3++SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
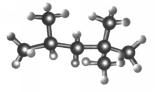 “辛烷值”用來表示汽油的質量,汽油中異辛烷的爆震程度最小,將其辛烷值標定為100,如圖是異辛烷的球棍模型,則異辛烷的系統命名為( )
“辛烷值”用來表示汽油的質量,汽油中異辛烷的爆震程度最小,將其辛烷值標定為100,如圖是異辛烷的球棍模型,則異辛烷的系統命名為( )| A. | 1,1,3,3-四甲基丁烷 | B. | 2,2,4-甲基庚烷 | ||
| C. | 2,4,4-三甲基戊烷 | D. | 2,2,4-三甲基戊烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

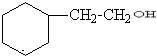 .
.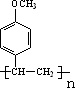 .
.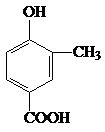 +CH3CH2OH$?_{△}^{濃H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{濃H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
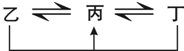 有A、B、C、D、E、F六種前四周期的元素,原子序數依次增大,A、B、C、D、E均為短周期元素,D和F元素對應的單質為日常生活中常見金屬.A原子核內只有一個質子,元素A與B形成的氣態化合物甲具有10e-、空間構型為三角錐形,C元素原子的最外層電子數是其電子層數的3倍,C與E同主族.圖中均含D或F元素的物質均會有圖示轉化關系:
有A、B、C、D、E、F六種前四周期的元素,原子序數依次增大,A、B、C、D、E均為短周期元素,D和F元素對應的單質為日常生活中常見金屬.A原子核內只有一個質子,元素A與B形成的氣態化合物甲具有10e-、空間構型為三角錐形,C元素原子的最外層電子數是其電子層數的3倍,C與E同主族.圖中均含D或F元素的物質均會有圖示轉化關系: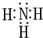 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com