
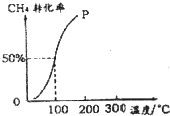
 甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.
甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.
| ||
| △t |
| 1 |
| 2 |
| ||
| 5min |
| 0.005×0.0153 |
| 0.005×0.015 |
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |


科目:高中化學 來源: 題型:
| A、若V1>V2,c1=c2,則混合溶液的PH>7 |
| B、若混合溶液的PH=7,則c1V1<c2V2 |
| C、若c1=c2,混合溶液中c(NH4+)=c(Cl-),則V1>V2 |
| D、以上說法均不正確 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、7a:10d |
| B、10a:7d |
| C、10b:7e |
| D、7e:11b |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、SO2和NO2溶于水都顯酸性,因而它們都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能導電,故均為電解質 |
| C、Si和SiO2均屬于原子晶體 |
| D、Na2O和Na2O2與水反應均會生成強堿,故都是堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、同溫度同物質的量濃度時,HF比HCN電離平衡常數大,則NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等體積混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物質的量濃度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同濃度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的順序是:③>②>①>④ |
查看答案和解析>>
科目:高中化學 來源: 題型:
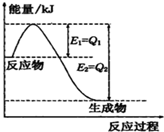 ①一定條件下,N2和H2反應生成lmolNH3過程中能量變化如圖所示,則1mol N2完全反應時的焓變為:
①一定條件下,N2和H2反應生成lmolNH3過程中能量變化如圖所示,則1mol N2完全反應時的焓變為:查看答案和解析>>
科目:高中化學 來源: 題型:
 將1.2mol的A氣體充入2L恒容密閉容器中發生反應:A(g)?2B(g).在三種不同條件下進行實驗,A的物質的量隨時間的變化如圖所示.試回答下列問題:
將1.2mol的A氣體充入2L恒容密閉容器中發生反應:A(g)?2B(g).在三種不同條件下進行實驗,A的物質的量隨時間的變化如圖所示.試回答下列問題:| 實驗編號及其目的 | V(容積)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化劑的質量/g | 催化劑的表面積/m2?g-1 |
| 實驗1 參照對比實驗 | 2 | 80 | 1.2 | 0 | a | b |
| 實驗4:催化劑的表面積對反應速率的影響 | ||||||
| 實驗5目的: | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com