
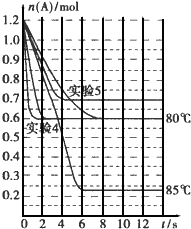
 將1.2mol的A氣體充入2L恒容密閉容器中發生反應:A(g)?2B(g).在三種不同條件下進行實驗,A的物質的量隨時間的變化如圖所示.試回答下列問題:
將1.2mol的A氣體充入2L恒容密閉容器中發生反應:A(g)?2B(g).在三種不同條件下進行實驗,A的物質的量隨時間的變化如圖所示.試回答下列問題:| 實驗編號及其目的 | V(容積)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化劑的質量/g | 催化劑的表面積/m2?g-1 |
| 實驗1 參照對比實驗 | 2 | 80 | 1.2 | 0 | a | b |
| 實驗4:催化劑的表面積對反應速率的影響 | ||||||
| 實驗5目的: | 1 |
| △c |
| t |
| A的濃度變化量 |
| A的起始濃度 |
| 1.2mol |
| 2L |
| 0.75 |
| 2L |
| 0.225mol/L |
| 4s |
| A的濃度變化量 |
| A的起始濃度 |
| 0.225mol/L |
| 0.6mol/L |
(
| ||
|
| 實驗編號及其目的 | V(容積)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化劑的質量/g | 催化劑的表面積/m2?g-1 |
| 2 | 80 | 1.2 | 0 | a | 2b(或nb(n>1)) | |
| 實驗5目的:壓強對反應速率的影響 | 80 | 1.2 | 0 | a | b |
 ;
;


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案 能考試全能100分系列答案
能考試全能100分系列答案科目:高中化學 來源: 題型:
| A、原混合物中銅和鐵各0.075 mol |
| B、稀硝酸的物質的量濃度為2.0 mol?L-1 |
| C、第一次剩余4.8 g 金屬為銅和鐵 |
| D、向反應后的溶液中再加入該稀硝酸100 mL,又得到NO在標準狀況下體積小于1.12 L |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、0.4molNaCl所含離子數 |
| B、標準狀況下5.6L CO2所含原子數 |
| C、1L1 mol?L-1鹽酸所含HCl分子數 |
| D、10g氖氣所含原子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:
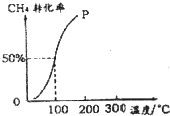 甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.
甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.查看答案和解析>>
科目:高中化學 來源: 題型:
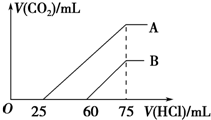 向濃度相等、體積均為50mL的A、B兩份NaOH溶液中,分別通入一定量的CO2后,再稀釋到100mL.
向濃度相等、體積均為50mL的A、B兩份NaOH溶液中,分別通入一定量的CO2后,再稀釋到100mL.查看答案和解析>>
科目:高中化學 來源: 題型:
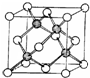 A、B、C、D、E五種元素的原子序數依次增大,其中A為周期表中原子半徑最小的元素;B原子的最外層電子數是其次外層電子數的2倍;C是地殼中含量最高的元素;Cn-與D+具有相同的電子層結構; E原子的3d能級中成對電子數與未成對電子數之比為4:3.試回答下列問題:
A、B、C、D、E五種元素的原子序數依次增大,其中A為周期表中原子半徑最小的元素;B原子的最外層電子數是其次外層電子數的2倍;C是地殼中含量最高的元素;Cn-與D+具有相同的電子層結構; E原子的3d能級中成對電子數與未成對電子數之比為4:3.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
| 元素 | 相關信息 |
| X | X是形成化合物種類最多的元素,它的一種氣態氧化物能產生溫室效應 |
| Y | Y是地殼中含量最多的元素 |
| Z | Z和Y形成的一種化合物Z2Y2為淡黃色粉末,可作為呼吸面具里氧氣的來源 |
| V | V的單質是淡黃色固體,是黑火藥的一種主要成分 |
| W | W的單質是人們最早發現和使用的金屬之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 化學式 | 電離常數 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A、同溫同濃度下,溶液的pH值:NaF>NaClO>Na2CO3 |
| B、結合H+ 的能力:ClO->CO32->F- |
| C、碳酸鈉溶液中加入少量氫氟酸的離子方程式:CO32-+2HF=2F-+H2O+CO2↑ |
| D、次氯酸鈉溶液中通少量二氧化碳的離子方程式:ClO-+CO2+H2O=HCO3-+HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:
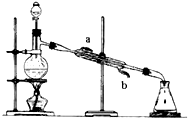 如圖所示的儀器裝置,在實驗室合成乙酸乙酯的粗產品.在蒸餾燒瓶內將過量的乙醇與適量濃硫酸混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾.得到含有乙醇、醋酸和水的乙酸乙酯粗產品.
如圖所示的儀器裝置,在實驗室合成乙酸乙酯的粗產品.在蒸餾燒瓶內將過量的乙醇與適量濃硫酸混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾.得到含有乙醇、醋酸和水的乙酸乙酯粗產品.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com