
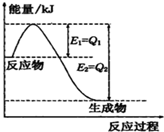
 ①一定條件下,N2和H2反應生成lmolNH3過程中能量變化如圖所示,則1mol N2完全反應時的焓變為:
①一定條件下,N2和H2反應生成lmolNH3過程中能量變化如圖所示,則1mol N2完全反應時的焓變為:| [NH4+]?[OH-] |
| [NH3?H2O] |
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
| [NH4+]?[OH-] |
| [NH3?H2O] |
| ||||
|
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |


科目:高中化學 來源: 題型:
| A、在汽車排氣管上加裝“催化轉化器”是為了減少有害氣體的排放 |
| B、硬鋁屬于合金材料,瓷器屬于硅酸鹽制品 |
| C、食醋可去除水垢,NH4Cl溶液可去除鐵銹 |
| D、煤經氣化、液化和干餾三個物理變化過程,可變為清潔能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 酸或堿 | 電離常數(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 難(微)溶物 | 溶度積常數(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根據溶度積常數(Ksp),甲同學認為除NaCl溶液中少量的MgCl2雜質需要加稍過量的NaOH溶液,而不是Na2CO3溶液;乙同學認為即使在BaSO4懸濁液中加過量的純堿溶液,BaSO4也不會轉化為BaCO3 |
| C、濃度相同的NaCN溶液和HCN的溶液等體積混合,其pH>7,溶液中各離子濃度大小為:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液顯中性,是因為根據電離常數,CH3COO-結合H+與NH4+結合OH-生成弱電解質的程度一樣,導致水溶液中的H+與OH-濃度相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:
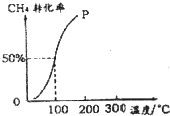 甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.
甲醇可作為燃料電池的原料.以CH4和H2O為原料,通過下列反應來制備甲醇.查看答案和解析>>
科目:高中化學 來源: 題型:
| A、兩個示蹤試驗是為了說明鹽類的水解是鹽中的弱的離子與水電離出的H+或OH-結合形成弱電解質的過程 |
| B、實驗①中,最終同位素D將存在于NH3?DHO、D2O、D+(或D3O+)中 |
| C、實驗②中,水解的離子方程式可表示為:CH3COO-+2H218O?CH3COOH+18OH- |
| D、若將NH4Cl溶于H218O和D2O的混合水中,將得到ND3?H218O |
查看答案和解析>>
科目:高中化學 來源: 題型:
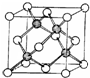 A、B、C、D、E五種元素的原子序數依次增大,其中A為周期表中原子半徑最小的元素;B原子的最外層電子數是其次外層電子數的2倍;C是地殼中含量最高的元素;Cn-與D+具有相同的電子層結構; E原子的3d能級中成對電子數與未成對電子數之比為4:3.試回答下列問題:
A、B、C、D、E五種元素的原子序數依次增大,其中A為周期表中原子半徑最小的元素;B原子的最外層電子數是其次外層電子數的2倍;C是地殼中含量最高的元素;Cn-與D+具有相同的電子層結構; E原子的3d能級中成對電子數與未成對電子數之比為4:3.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
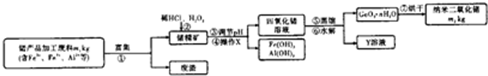
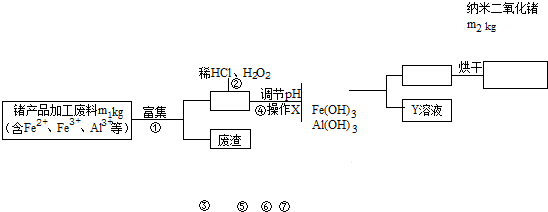
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com