
【題目】氮化硅(Si3N4)是一種新型陶瓷材料,它可以由石英與焦炭在高溫下的氮氣流中,通過以下反應制得:3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)該反應的平衡常數表達式為K=___________________;
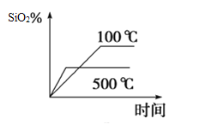
(2)不同溫度下SiO2的平衡轉化率隨時間的變化如圖所示,則該反應為___________反應(填“吸熱”或“放熱”);升高溫度,其平衡常數值將___________(填“增大”“ 減小”或“不變”);
(3)已知反應達到平衡時,CO的生成速率為v (CO) =18 mol·L-1·min-1,則N2消耗速率為v(N2)=
____________mol·L-1·min-1。
(4)反應達到平衡時,壓縮容器的體積,平衡將向________反應方向移動(填“正”或“逆”);
【答案】K=c6(CO)/c2(N2) 放熱 減小 6 逆
【解析】
(1)可逆反應3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)的平衡常數k=![]() ;
;
(2)不同溫度下SiO2的平衡轉化率隨時間的變化如圖所示,則升高溫度二氧化硅的平衡轉化率降低,平衡向逆反應方向移動,故該反應為放熱反應;升高溫度,平衡向逆反應方向移動,則其平衡常數值將減小;
(3)已知反應達到平衡時,正反應速率等于逆反應速率,且反應速率之比等于化學計量數之比,CO的生成速率與消耗速率均為v (CO) =18 mol·L-1·min-1,則N2消耗速率為v(N2)= ![]() v (CO) =
v (CO) =![]() 18 mol·L-1·min-1=6mol·L-1·min-1;
18 mol·L-1·min-1=6mol·L-1·min-1;
(4)反應達到平衡時,壓縮容器的體積,相當于增大壓強,平衡將向氣體體積縮小逆反應方向移動。


科目:高中化學 來源: 題型:
【題目】食品安全備受社會關注。下列做法符合食品安全要求的是( )
A.在食用豬血中加甲醛溶液
B.在奶粉中添加三聚氰胺以提高蛋白質含量
C.在焙制面包時添加小蘇打
D.在玉米饅頭中添加合成色素檸檬黃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】300 ℃時,將2 mol A和2 mol B兩種氣體混合于2 L密閉容器中,發生如下反應:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
(1)300 ℃時,該反應的平衡常數表達式為:K=___________________。已知K300 ℃<K350 ℃,則ΔH______0(填“>”或“<”)。
(2)在2 min末時,B的平衡濃度為________,D的平均反應速率為________。
(3)若溫度不變,縮小容器容積,則A的轉化率______(填“增大”“減小”或“不變”),原因是_____________________________________________________________。
(4)如果在相同的條件下,上述反應從逆反應方向進行,開始時加入C、D各4/3mol。若使平衡時各物質的物質的量濃度與原平衡相同,則還應該加入B______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在時反應過程中的能量變化如圖所示。下列敘述正確的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在時反應過程中的能量變化如圖所示。下列敘述正確的是
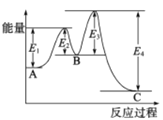
A. △H= E4- E3+E2-E1
B. 加入V2O5后反應經過兩步完成,其中第一步決定反應速率
C. 加入V2O5,△H不變,但反應速率改變
D. 向密閉容器中充入2molSO2和1molO2,發生上述反應達平衡時,反應放熱198kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨原子序數的遞增,八種短周期元素(用字母x等表示)原子半徑的相對大小、最高正價或最低負價的變化如下圖所示。
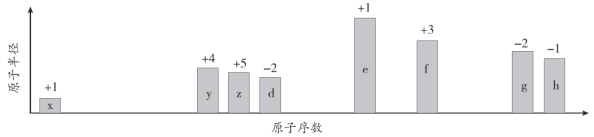
根據判斷出的元素回答問題:
(1)f在元素周期表的位置是__________________。
(2)比較d、e常見離子的半徑大小(用化學式表示,下同)______>_______;比較g、h的最高價氧化物對應的水化物的酸性強弱是:_______>____。
(3)畫出x2d2的電子式:____________________;
(4)已知1mol e的單質在足量d2中燃燒,恢復至室溫,放出255.5kJ熱量,寫出該反應的熱化學方程式:____________________________________________。
(5)寫出用惰性電極電解eh溶液的化學方程式:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非金屬元素及其化合物在物質制備、生產生活中發揮著重要作用。
I.CO2與NH3合成尿素的反應如下:CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) △H=akJ/mol
[CO(NH2)2](s)+H2O(g) △H=akJ/mol
曲線表示不同溫度、不同壓強下,CO2的平衡轉化率與溫度的關系,請回答下列問題:

(1)a__________0,P1__________P2(填“>”、“<”或“=”)。
(2)t℃時,向容積為2L的密閉容器中充入3molNH3和1molCO2,實現M點的平衡,則
①平衡時容器內壓強為開始時的____________倍,t℃時的化學平衡常數為__________。
②若保持條件不變,再向該容器中充入1molNH3和1molCO2,NH3的轉化率將________(填“增大”、“減小”或“不變”)。
II.硫及其化合物在生產生活中應用廣泛,回答下列問題。
(1)鐵銨礬是一種化學物質,分子式為NH4Fe(SO4)212H2O,其溶于水后,溶液中離子濃度大小關系為________________________________。
(2)已知某溶液中含有CO32-、SO42-等離子,取一定量的該溶液向其中加入 BaCl2溶液,當CO32-開始沉淀時,溶液中![]() 為____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
為____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
(3)恒溫恒容密閉容器中發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。下列能說明反應達到平衡狀態的是___________。
2SO3(g) △H=-197kJ/mol。下列能說明反應達到平衡狀態的是___________。
a.體系壓強保持不變 b.混合氣體的密度保持不變
c.SO3和O2的體積比保持不變 d.每消耗1molSO3的同時生成0.5molO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產硫酸的過程中,SO2在接觸室中被催化氧化為SO3氣體,已知該反應為放熱反應。現將2 mol SO2、1 mol O2充入一密閉容器中充分反應后,放出熱量98.3 kJ,此時測得SO2的轉化率為50%,則下列熱化學方程式正確的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=98.3 kJ·mol1
2SO3(g) ΔH=98.3 kJ·mol1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol1
SO3(g) ΔH=+98.3 kJ·mol1
D. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=49.2 kJ·mol1
SO3(g) ΔH=49.2 kJ·mol1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com