
【題目】非金屬元素及其化合物在物質制備、生產生活中發揮著重要作用。
I.CO2與NH3合成尿素的反應如下:CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) △H=akJ/mol
[CO(NH2)2](s)+H2O(g) △H=akJ/mol
曲線表示不同溫度、不同壓強下,CO2的平衡轉化率與溫度的關系,請回答下列問題:

(1)a__________0,P1__________P2(填“>”、“<”或“=”)。
(2)t℃時,向容積為2L的密閉容器中充入3molNH3和1molCO2,實現M點的平衡,則
①平衡時容器內壓強為開始時的____________倍,t℃時的化學平衡常數為__________。
②若保持條件不變,再向該容器中充入1molNH3和1molCO2,NH3的轉化率將________(填“增大”、“減小”或“不變”)。
II.硫及其化合物在生產生活中應用廣泛,回答下列問題。
(1)鐵銨礬是一種化學物質,分子式為NH4Fe(SO4)212H2O,其溶于水后,溶液中離子濃度大小關系為________________________________。
(2)已知某溶液中含有CO32-、SO42-等離子,取一定量的該溶液向其中加入 BaCl2溶液,當CO32-開始沉淀時,溶液中![]() 為____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
為____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
(3)恒溫恒容密閉容器中發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。下列能說明反應達到平衡狀態的是___________。
2SO3(g) △H=-197kJ/mol。下列能說明反應達到平衡狀態的是___________。
a.體系壓強保持不變 b.混合氣體的密度保持不變
c.SO3和O2的體積比保持不變 d.每消耗1molSO3的同時生成0.5molO2
【答案】< > 0.75 1 增大 c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-) 25 a c
【解析】
I.(1)根據溫度、壓強對平衡移動的影響分析判斷;
(2) ①利用在恒容密閉容器中氣體的物質的量的比等于壓強比計算,根據平衡常數定義式計算;
②根據兩次加入的NH3、CO2的比例分析物質的平衡轉化率變化;
II.(1)根據物料守恒、鹽的水解規律比較;
(2)利用溶度積常數計算;
(3)當反應處于平衡狀態時,各種物質的含量不變,物質的量濃度不變,混合氣體的壓強不變。
I.(1)根據圖像可知:在其它條件不變時,升高溫度,CO2轉化率降低,說明平衡逆向移動,根據平衡移動原理,升高溫度,平衡向吸熱方向移動,逆反應為吸熱反應,則該反應的正反應為放熱反應,所以△H=a<0;該反應的正反應為氣體體積減小的反應,在其它條件不變時,增大壓強,平衡正向移動,CO2轉化率增大,所以P1>P2;
(2)① t℃時,向容積為2L的密閉容器中充入3molNH3和1molCO2,
發生反應: CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) M點實現化學平衡
[CO(NH2)2](s)+H2O(g) M點實現化學平衡
c(始)mol/L 0.5 1.5 0
c(變)mol/L 0.25 0.5 0.25
c(平)mol/L 0.25 1.0 0.25
K=![]() ,平衡時氣體的物質的量n=0.25×2+1.0×2+0.25×2=3,開始時氣體的物質的量是3+1=4mol,對于氣體來說,壓強比等于氣體的氣體物質的量的比,所以
,平衡時氣體的物質的量n=0.25×2+1.0×2+0.25×2=3,開始時氣體的物質的量是3+1=4mol,對于氣體來說,壓強比等于氣體的氣體物質的量的比,所以![]()
②若保持條件不變,再向該容器中充入1molNH3和1molCO2,CO2與 NH3增大的比例比原來大,相當于增大了CO2的濃度,所以NH3的轉化率將增大;
鐵銨礬是一種化學物質,分子式為NH4Fe(SO4)212H2O
II.(1) 鐵銨礬溶于水后,電離方程式為NH4Fe(SO4)212H2O=NH4++Fe3++2SO42-,由于Fe3+和NH4+都發生水解反應,消耗水電離產生的OH-,所以到達水解平衡時,溶液顯酸性,c(H+)>c(OH-);由于Fe(OH)3的電離平衡常數比NH3H2O小,Fe3+水解程度比NH4+大,所以c(NH4+)>c(Fe3+),鹽電離產生的離子濃度大于水的電離程度,故溶液中離子濃度大小關系為c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-);
(2)向含有CO32-、SO42-離子的該溶液向其中加入 BaCl2溶液,當CO32-開始沉淀時,溶液中![]() =
=![]() =25;
=25;
(3) a.在恒容密閉容器中發生的該反應是氣體體積不等的反應,若體系壓強保持不變,則氣體的物質的量不變,反應達到平衡,a正確;
b.反應混合物都是氣體,任何情況下密度都不變,所以不能確定反應是否達到平衡,b錯誤;
c. SO3和O2一種是生成物,一種是反應物,若二者的體積比保持不變,說明反應達到平衡狀態,c正確;
d.根據物質反應時變化的物質的量關系可知,在任何情況下每消耗1molSO3的同時生成0.5molO2,因此不能據此判斷反應處于平衡狀態,d錯誤;
故合理選項是ac。


科目:高中化學 來源: 題型:
【題目】氮化硅(Si3N4)是一種新型陶瓷材料,它可以由石英與焦炭在高溫下的氮氣流中,通過以下反應制得:3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)該反應的平衡常數表達式為K=___________________;
(2)不同溫度下SiO2的平衡轉化率隨時間的變化如圖所示,則該反應為___________反應(填“吸熱”或“放熱”);升高溫度,其平衡常數值將___________(填“增大”“ 減小”或“不變”);
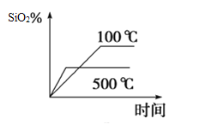
(3)已知反應達到平衡時,CO的生成速率為v (CO) =18 mol·L-1·min-1,則N2消耗速率為v(N2)=
____________mol·L-1·min-1。
(4)反應達到平衡時,壓縮容器的體積,平衡將向________反應方向移動(填“正”或“逆”);
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】開發、使用清潔能源發展“低碳經濟”正成為科學家研究的主要課題。氫氣、甲醇是優質的清潔燃料,可制作燃料電池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1,②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1,③H2O(g)=H2O(l) ΔH3= -44.0 kJ·mol-1,
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:_______________。
(2)工業上一般可采用如下反應來合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某溫度下,將2mol CO和6mol H2充入2L的密閉容器中,充分反應10min后,達到平衡時測得c(CO)=0.2mol/L,則CO的轉化率為____,以CH3OH表示該過程的反應速率v(CH3OH)=______。
②要提高反應2H2(g)+CO(g)CH3OH(g)中CO的轉化率,可以采取的措施是_______。
a.升溫 b.加入催化劑 c.增加CO的濃度 d.加入H2 e.加入惰性氣體 f.分離出甲醇
(3)如圖是一個化學過程的示意圖:

①圖中甲池是________裝置(填“電解池”或“原電池”),其中OH-移向________極(填“CH3OH”或“O2”)。
②寫出通入CH3OH的電極的電極反應式: ____________________________。
③乙池中總反應的離子方程式為______________________________________。
④當乙池中B(Ag)極的質量增加5.40g時,此時丙池某電極析出1.60g某金屬,則丙中的某鹽溶液可能是________(填序號)。
A.MgSO4 B.CuSO4 C.NaCl D.Al(NO3)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
①工業合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0,反應條件選擇高溫
2NH3(g) △H<0,反應條件選擇高溫
②實驗室可以用排飽和食鹽水的方法收集氯氣
③硫酸工業中2SO2+O2![]() 2SO3,增大O2的濃度有利于提高SO2的轉化率
2SO3,增大O2的濃度有利于提高SO2的轉化率
④對CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡體系增大壓強可使顏色變深
CO2(g) + NO(g)平衡體系增大壓強可使顏色變深
A. ②③ B. ②④ C. ①③ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對下列圖像描述正確的是

A. 圖①可表示將氨氣通入醋酸溶液至過量過程中溶液導電性的變化
B. 根據圖②可判斷可逆反應A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 圖③表示等體積、等pH的鹽酸與醋酸溶液分別與足量的鋅粉發生反應產生氫氣的體積(V)隨時的變化的示意圖
D. 圖④可表示壓強對可逆反應A(g)+B(g)![]() 2C(g)+D(g)的影響,乙的壓強大
2C(g)+D(g)的影響,乙的壓強大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2CO3 | HC1O |
電離平衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
請回答下列問題:
(1)CH3COOH、H2CO3、HC1O的酸性由強到弱的順序為______________________。
(2)常溫下0.1 mol·L-1的CH3COOH溶液,若升髙溫度,上述4種表達式的數據增大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作導電性實驗,測得其導電率隨加入的水量變化如圖所示:比較a、b點的相關性質(填“>”“<”或“=”):

n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和時消耗NaOH的物質的量∶a_____b;
(4)H+濃度相同等體積的兩份溶液A(鹽酸)和B(CH3COOH)分別與鋅粉反應,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,則下列說法正確的是__________(填寫序號)
①反應所需要的時間B>A ②開始反應時的速率A>B
③參加反應的鋅的物質的量A=B ④A中有鋅剩余
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵素及其化合物廣泛存在于自然界中。回答下列問題:
(1)光氣(COCl2)是一種重要的有機中間體,在農藥、醫藥、工程塑料、聚氨酯材料以及軍事上都有許多用途。光氣的分子立體構型為______________,其三種元素的電負性由小到大的順序為______________。與COCl2互為等電子體的分子和離子(各寫一種)__________。
(2)日常生活中,看到的許多可見光,如霓虹燈,試從原子結構角度解釋這一現象?____________________________。
(3)區分晶態二氧化硅和非晶態二氧化硅最可靠的科學方法是_____________。
(4)一種銅的溴化物晶胞結構如圖所示,若將圖中的Cu去掉,再把所有的Br換成Cu,得到晶體銅的晶胞結構,則晶體銅的堆積方式為___________,某同學將基態銅原子價電子錯誤的寫為3d94s2,違背了核外電子排布規律中的______。

(5)下列關于上述銅的溴化物晶胞結構說法正確的是_________(選填字母序號)。
A.該化合物的化學式為CuBr2
B.銅的配位數為8
C.與每個Br緊鄰的Br有12個
D.由圖中P點和Q點的原子坐標參數,確定R點的原子坐標參數為(1/4,1/4,1/4)
(6)若圖中P點和R點的原子核間距為a cm,NA為阿伏伽德羅常數的值,則該晶胞密度為______g/cm3。(列出計算式即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖象與所對應的實驗相符的是( )
A. 向硫酸溶液中不斷加水 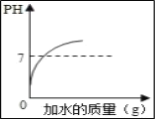
B. 一定量的稀硫酸與鋅粒反應 
C. 加熱二氧化錳和氯酸鉀的混合物 
D. 向稀H2SO4中滴加BaCl2溶液 
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com