
| A. | 用直接加熱并蒸干FeCl3溶液的方法可制得純凈的無水FeCl3 | |
| B. | 等物質的量濃度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者 | |
| C. | 中和等體積、等物質的量濃度的鹽酸和醋酸溶液,消耗NaOH的物質的量不相等 | |
| D. | 對于有氣體參加的反應,增大氣體反應物濃度,活化分子百分數增大,反應速率加快 |
分析 A.三氯化鐵在溶液中存在水解平衡,從平衡移動的角度分析蒸干溶液得到水解產物;
B.碳酸根離子水解程度大于醋酸根離子溶液堿性強;
C.中和等體積、等物質的量濃度的鹽酸和醋酸溶液,消耗NaOH的物質的量不相等;
D.增大壓強、濃度,單位體積活化分子的數目增多,活化分子的百分數不變;
解答 解:A.在FeCl3溶液中,Fe3+發生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加熱蒸發,使HCl揮發,破壞平衡,使平衡不斷向右移動,結果生成Fe(OH)3,故A錯誤;
B.碳酸根離子水解程度大于醋酸根離子溶液堿性強,等物質的量濃度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者,故B正確;
C.等體積、等物質的量濃度的鹽酸和醋酸溶液,溶質物質的量相同,與氫氧化鈉反應,分別發送生HCl+NaOH=NaCl+H2O,CH3COOH+NaOH=CH3COONa+H2O,即中和等體積、等物質的量濃度的鹽酸和醋酸溶液,所需氫氧化鈉相同,故C錯誤;
D.增大體系壓強只增大單位體積活化分子的數目,反應速率加快,百分數不變,故D錯誤;
故選B.
點評 本題考查鹽類的水解、酸堿反應特征分析,酸堿中和反應,恰好中和是按照化學方程式的定量計算關系判斷,題目難度中等,注意水解平衡移動的影響因素.


科目:高中化學 來源: 題型:多選題
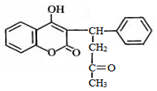
| A. | 分子中有1個手性碳原子 | B. | 遇FeCl3溶液顯紫色 | ||
| C. | 1mol殺鼠靈最多能與9molH2反應 | D. | 能發生加成、取代、氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KC1O3是氧化劑 | |
| B. | P2O5是氧化產物 | |
| C. | 1 mol KC1O3參加反應有6 mol e-轉移 | |
| D. | 每有6 mol P被還原,生成5 mol KCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH試紙呈紅色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水電離出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 有較多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鉑絲蘸取某未知溶液于酒精燈火焰上灼燒,火焰顯黃色,證明該溶液中不含K+ | |
| B. | 向某未知溶液中先滴加氯水,再滴加KSCN溶液,出現血紅色,證明溶液中含有Fe2+ | |
| C. | 萃取碘水中的碘時,可以選擇苯或四氧化碳作為萃取劑 | |
| D. | 某無色溶液中加入硝酸銀溶液后產生白色沉淀,再加入稀鹽酸沉淀不消失,證明原溶液中含有Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉和水反應放熱 | B. | 金屬鈉和水反應產生可燃燒的氫氣 | ||
| C. | 可在現場使用干沙滅火 | D. | 可在現場使用高壓水槍滅火 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體最多 | B. | 液體比氣體多 | C. | 固體最多 | D. | 以上都不對 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com