
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子個數比 | A:C=1:1 | B:C=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的結構式
,丁的結構式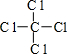
 .
.分析 原子序數依次增大的A、B、C、D、E五種短周期元素,B原子最外層電子數比其次外層電子數多兩個,原子只能有2個電子層,最外層電子數為4,則B為碳元素;A、B兩種原子的核電荷數之差等于它們的原子最外層電子數之和,二者不可能同周期,原子序數小于碳,只能處于第一周期,可推知A為H元素;D和E位于同一周期,且D和E的原子序數之和為30,則二者處于第三周期,為Al與Cl或Si與S,且B、E形成的化合物丁在B:E=1:4,則D為Al、E為Cl;C是E的鄰族元素,化學性質活潑,C的原子序數小于鋁,則C為氧元素,可推知甲為H2O2,乙為CO2,丙為AlCl3,丁為CCl4,據此進行解答.
解答 解:原子序數依次增大的A、B、C、D、E五種短周期元素,B原子最外層電子數比其次外層電子數多兩個,原子只能有2個電子層,最外層電子數為4,則B為碳元素;A、B兩種原子的核電荷數之差等于它們的原子最外層電子數之和,二者不可能同周期,原子序數小于碳,只能處于第一周期,可推知A為H元素;D和E位于同一周期,且D和E的原子序數之和為30,則二者處于第三周期,為Al與Cl或Si與S,且B、E形成的化合物丁在B:E=1:4,則D為Al、E為Cl;C是E的鄰族元素,化學性質活潑,C的原子序數小于鋁,則C為氧元素,可推知甲為H2O2,乙為CO2,丙為AlCl3,丁為CCl4,
(1)由上面的分析可知,甲為H2O2,電子式為 ;丁為CCl4,其結構式為:
;丁為CCl4,其結構式為: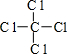 ,
,
故答案為: ;
;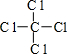 ;
;
(2)E為氯元素,位于周期表中第三周期ⅦA族,其最簡單離子為氯離子,核電荷數為17,最外層導電8電子穩定結構,其離子結構示意圖為: ,
,
故答案為:第三周期ⅦA族; ;
;
(3)五種元素中,既可以與鹽酸反應,又可以與氫氧化鈉溶液反應的是Al,反應的離子方程式為:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:Al;2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
點評 本題考查原子結構與元素周期律的關系,題目難度中等,側重對化學用語的考查,正確推斷元素為解題關鍵,注意熟練掌握原子結構與元素周期律、元素周期表的關系.


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案科目:高中化學 來源: 題型:解答題
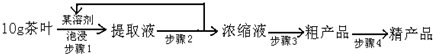
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 沒有單質參加的化合反應一定不屬于氧化還原反應 | |
| B. | 離子反應一定屬于氧化還原反應 | |
| C. | 有的復分解反應屬于氧化還原反應 | |
| D. | 置換反應一定屬于氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | 澄清石灰水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在101 kPa時,1 mol H2完全燃燒生成氣態水,放出285.8 kJ熱量,H2的燃燒熱為-285.8 kJ•mol-1 | |
| B. | 測定HCl和NaOH反應的中和熱時,每次實驗均應測量3個溫度,即鹽酸起始溫度,NaOH起始溫度和反應后終止溫度 | |
| C. | 在101 kPa時,1 mol C與適量O2反應生成1 mol CO時,放出110.5 kJ熱量,則C的燃燒熱為110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量等于57.3 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3Cl | B. | (CH3)3CBr | C. | (CH3)3CCH2Cl | D. | (CH3)2CBrCH(CH3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
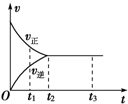
| A. | t1時,只有正方向反應 | B. | 0~t1,c(Z)在減小 | ||
| C. | t2~t3,反應不再進行 | D. | t2~t3,各物質的濃度不再發生變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com