
| A. | c(HCl)>c(CH3COOH) | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等體積的鹽酸和醋酸溶液分別與足量的Zn完全反應,鹽酸產生的H2多 | |
| D. | 用同濃度的NaOH溶液分別與等體積的鹽酸和醋酸溶液恰好反應完全,鹽酸消耗的NaOH溶液體積多 |
分析 A.醋酸為弱酸,在溶液中只能部分電離出氫離子,據此判斷二者濃度大小;
B.根據兩溶液中的電荷守恒判斷;
C.醋酸濃度較大,則與足量鋅反應時醋酸放出的氫氣多;
D.醋酸的濃度大于鹽酸,則醋酸溶液消耗的氫氧化鈉溶液體積大.
解答 解:A.醋酸為弱電解質,在溶液中部分電離,若pH相等時,醋酸濃度較大,即c(HCl)<c(CH3COOH),故A錯誤;
B.溶液的pH相等,則兩溶液中的氫離子、氫氧根離子濃度相等,根據電荷守恒可知c(Cl-)=c(CH3COO-),故B正確;
C.等體積的鹽酸和醋酸溶液分別與足量的Zn完全反應,由于醋酸的濃度較大,則醋酸產生的H2多,故C錯誤;
D.同濃度的NaOH溶液分別與等體積的鹽酸和醋酸溶液恰好反應完全,由于醋酸的濃度大于鹽酸,則醋酸消耗的NaOH溶液體積多,故D錯誤;
故選B.
點評 本題考查了弱電解質的電離及其影響,題目難度中等,明確弱電解質的電離特點為解答關鍵,注意掌握溶液酸堿性與溶液pH的關系,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:解答題
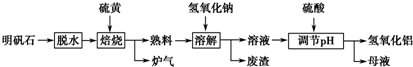
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
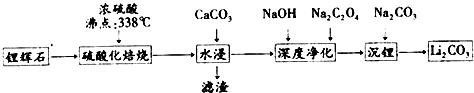
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某試樣焰色反應呈黃色,則試樣中含有K+ | |
| B. | 廣泛pH試紙測得某堿性溶液的pH為12.5 | |
| C. | 容量瓶不能用作溶解物質的容器 | |
| D. | 粗鹽的提純試驗中,濾液在坩堝中加熱蒸發結晶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硬脂酸甘油酯屬于高級脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纖維素的物質可以制造酒精 | |
| C. | 雞蛋清的溶液中加入硫酸銅溶液,雞蛋清凝聚,蛋白質變性 | |
| D. | 不同種類的氨基酸能以不同的數目和順序彼此結合,形成更復雜的多肽化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 烷烴C5H12的同分異構體中,主鏈最短的一種系統命名為2,2-甲基丙烷 | |
| B. | 石油分餾和裂化的目的都是為了將長鏈烴轉化為短鏈烴 | |
| C. | 蛋白質溶液中加入硫酸銅溶液,導致蛋白質變性,失去生理活性 | |
| D. | 高分子化合物(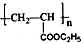 )的單體是CH2=CH2和C2H5COOH )的單體是CH2=CH2和C2H5COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol FeCl3 水解生成的Fe(OH)3膠粒數為lNA | |
| B. | 4.6g有機物C2H6O的分子結構中含有的C一H鍵數目一定為0.5NA | |
| C. | 標準狀況下,11.2 L CO2 與足量Na2O2反應轉移的電子數為0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA個Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,7.8 gNa2S和Na2O2的混合物中,陰離子所含電子數為1.8NA | |
| B. | 標準狀況下,11.2 L 二氯甲烷中含有的分子數目為0.5NA | |
| C. | 常溫常壓下,28 g乙烯與丙烯的混合氣體含有的碳原子數目無法計算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+數目小于0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com