
 ;該微粒還可與Cu2+形成[Cu(H2O)4]+(填化學式)而使CuCl2溶液呈藍色;
;該微粒還可與Cu2+形成[Cu(H2O)4]+(填化學式)而使CuCl2溶液呈藍色;分析 A、B、C、D四種短周期元素,A元素的氣態氫化物分子式為AH4,其中A元素的質量分數為75%,設A的相對原子質量為x,則$\frac{x}{x+4}$×100%=75%,解得x=12,該元素原子核內有6個中子,故A為碳元素;A能與B形成AB2型化合物,則B為-2價,B的氫化物為H2B,B在它的氫化物中含量為88.9%,設B的相對原子質量為y,則$\frac{y}{y+2}$×100%=88.9%,解得y=16,B核內質子數和中子數相等,則B為氧元素;C、D為同周期元素,D的最高價氧化物的水化物為酸性最強的酸,C的氧化物為兩性氧化物,則D為Cl元素、C為Al元素,據此進行解答.
解答 解:A、B、C、D四種短周期元素,A元素的氣態氫化物分子式為AH4,其中A元素的質量分數為75%,令A的相對原子質量為x,則$\frac{x}{x+4}$×100%=75%,解得x=12,該元素原子核內有6個中子,故A為碳元素;A能與B形成AB2型化合物,則B為-2價,B的氫化物為H2B,B在它的氫化物中含量為88.9%,令B的相對原子質量為y,則$\frac{y}{y+2}$×88.9%,解得y=16,B核內質子數和中子數相等,則B為氧元素;C、D為同周期元素,D的最高價氧化物的水化物為酸性最強的酸,C的氧化物為兩性氧化物,則D為Cl元素、C為Al元素,
(1)碳元素的一種無色透明的單質是金剛石,屬于原子晶體,
故答案為:金剛石;原子晶體;
(2)氧原子的核外電子總數為8,其核外電子排布式為1s22s22p4;由于O的非金屬性比S強(或H-O鍵鍵能比H-S強),所以簡單氫化物的穩定性比H2S強;
由于H2O分子之間有氫鍵,大大增強了水分子之間作用力,導致水的沸點比H2S高;
以一個該分子為中心的水分子晶體中微粒間氫鍵可以表示為: ;
;
銅離子與水分子之間可以通過配位鍵形成;[Cu(H2O)4]+,所以溶液呈藍色,
故答案為:1s22s22p4;O的非金屬性比S強(或H-O鍵鍵能比H-S強); ;[Cu(H2O)4]+;
;[Cu(H2O)4]+;
(3)A和B形成化合物為CO2,分子中C原子呈2個C=O雙鍵,不含孤對電子,C原子采取sp雜化,為直線型結構,正負電荷重心重合,為非極性分子,晶體類型是分子晶體;干冰是分子晶體,CO2分子位于立方體的頂點和面心上,以頂點上的CO2分子為例,與它距離最近的CO2分子分布在與該頂點相連的12個面的面心上,
故答案為:直線型;非極性;干冰;sp;12;
(4)C和D的化合物為氯化鋁,溶于水后,向其中滴入過量KOH,先發生Al3++3OH-═Al(OH)3↓,此時觀察到有沉淀產生,后發生Al(OH)3+OH-═AlO2-+2H20,則觀察到沉淀消失,
故答案為:先生成沉淀后沉淀消失;Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H20.
點評 本題考查了位置、結構與性質關系的綜合應用,題目難度中等,推斷各元素為解答關鍵,注意熟練掌握原子結構與元素周期律、元素周期表之間的關系,試題側重考查學生的分析、理解能力及靈活應用能力.


 課堂小作業系列答案
課堂小作業系列答案 黃岡小狀元口算速算練習冊系列答案
黃岡小狀元口算速算練習冊系列答案 成功訓練計劃系列答案
成功訓練計劃系列答案 倍速訓練法直通中考考點系列答案
倍速訓練法直通中考考點系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | a | b | c | 實驗現象 |  |
| A | 濃鹽酸 | MnO2 | 品紅溶液 | 品紅褪色 | |
| h | 硫酸 | NaHCO3 | Na2SiO3 | 有白色色膠狀沉淀產生 | |
| r | 濃氨水 | 生石灰 | AlCl3溶液 | 白色沉淀生成,后沉淀消失 | |
| D | 70%H2SO4 | Na2SO3 | 紫色石蕊溶液 | 溶液先變紅.后褪色 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 是環戊烯的結構簡式,可進一步簡寫為
是環戊烯的結構簡式,可進一步簡寫為 ,環戊烯的化學性質跟鏈烯烴相似.
,環戊烯的化學性質跟鏈烯烴相似.
 )臭氧化分解各種產物的結構簡式及其物質的量之比n(HCHO):n(CH3COCHO)=2:1.
)臭氧化分解各種產物的結構簡式及其物質的量之比n(HCHO):n(CH3COCHO)=2:1.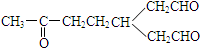 ,A經催化加氫得產物B,B的分子式是C10H20.分析數據表明,分子B內含有六元碳環.則A的鍵線式為
,A經催化加氫得產物B,B的分子式是C10H20.分析數據表明,分子B內含有六元碳環.則A的鍵線式為 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ⅡA族中無非金屬元素 | |
| B. | 零族的所有元素均滿足最外層電子數為8 | |
| C. | 元素周期表中18個縱行對應18個族 | |
| D. | Ⅷ族中所含元素種類最多 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 甲烷的燃燒熱為890.3kJ•mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| B. | 500℃、30 MPa下,將0.5 mol N2和1.5 mol H2置于密閉的容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃,101kPa下,1gH2燃燒生成水蒸氣放出121kJ熱量,其熱化學方程式為H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| D. | 25℃,101Kpa時,強酸與強堿的稀溶液發生反應的中和熱為57.3kJ•mol-1,硫酸稀溶液與氫氧化鉀稀溶液反應的熱化學方程式可表示為:H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(1)△H=-114.6kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對該反應體系加熱 | B. | 不用鐵片,改用鐵粉 | ||
| C. | 不用稀硫酸,改用98%的濃硫酸 | D. | 滴加少量的CuSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯水保存在棕色瓶中,冷暗處放置 | B. | 漂白粉可以敞口放置在空氣中 | ||
| C. | 液氯可以保存在干燥的鋼瓶中 | D. | Na在盛煤油的試劑瓶中密封保存 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若升高溫度,氣體顏色將變深 | |
| B. | 平衡時NO2和N2O4的物質的量之比為1:2 | |
| C. | 平衡時混合氣體的平均相對分子質量約為76.7 | |
| D. | 若相同溫度下的另一容器中N2O4濃度為0.03mol/L,NO2濃度為0.01mol/L時,反應速率的關系為v正<v逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫化物熔沸點:HmX>HmY | |
| B. | X、Y、Z形成的化合物一定顯中性 | |
| C. | 離子半徑:Y<Z | |
| D. | X與Z可形成多種化合物,且化學鍵類型完全相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com