
| A. | 亞硫酸鈉溶液加入稀硝酸:SO32-+2 H+═SO2+H2O | |
| B. | 向氯化鐵溶液中加入氫氧化鎂:3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3 | |
| C. | 硫酸氫鈉溶液與氫氧化鋇溶液反應至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向硅酸鈉溶液中通入足量的二氧化硫:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
分析 A.二者發生氧化還原反應生成硫酸根離子和NO;
B.溶解度大的物質能轉化為溶解度小的物質;
C.要使混合溶液呈中性,則二者應該以2:1反應,生成硫酸鋇、硫酸鈉和水;
D.二者反應生成硅酸和亞硫酸氫鈉.
解答 解:A.二者發生氧化還原反應生成硫酸根離子和NO,離子方程式為3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故A錯誤;
B.溶解度大的物質能轉化為溶解度小的物質,氫氧化鎂溶解度大于氫氧化鐵,所以發生的離子方程式為:3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3,故B正確;
C.要使混合溶液呈中性,則二者應該以2:1反應,生成硫酸鋇、硫酸鈉和水,離子方程式為Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C錯誤;
D.二者反應生成硅酸和亞硫酸氫鈉,離子方程式為SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故D錯誤;
故選B.
點評 本題考查離子方程式正誤判斷,為高頻考點,明確物質性質及離子方程式書寫規則是解本題關鍵,離子方程式書寫要遵循客觀事實、原子守恒、電荷守恒、轉移電子守恒,有些化學反應還與反應物的量有關,注意A中發生氧化還原反應,為易錯點.


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:選擇題

| A. | 用濃鹽酸和MnO2反應制取Cl2 | |
| B. | 用濃硫酸與Na2SO3反應制取SO2 | |
| C. | 用H2O2溶液和MnO2反應制取O2 | |
| D. | 用NH4Cl濃溶液和Ca(OH)2濃溶液反應制取NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
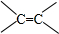 $\frac{\underline{\;[O]\;}}{\;}$
$\frac{\underline{\;[O]\;}}{\;}$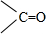 +
+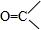
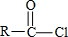 +H2O→
+H2O→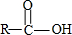 +HCl
+HCl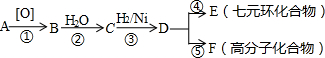
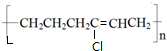 、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH
、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH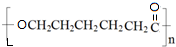 +nH2O,縮聚反應.
+nH2O,縮聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸與鐵屑反應:Fe+2H+=Fe2++H2↑ | |
| B. | 鈉與CuSO4溶液反應:2Na+Cu2+=Cu↓+2Na+ | |
| C. | 碳酸鈣與鹽酸反應:CO32-+2H+=CO2↑+H2O | |
| D. | 硫酸和氫氧化鋇溶液反應:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:Na2CO3>NaHCO3 | |
| B. | 相同溫度下,0.1mol•L-1鹽溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 相同條件下,與HCl反應的劇烈程度:Na2CO3<NaHCO3 | |
| D. | 等物質的量的NaHCO3和Na2CO3與足量稀鹽酸反應產生CO2的質量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 分別滴加稀鹽酸,看有無氣泡產生 | |
| B. | 分別取樣在試管中加熱,將可能產生的氣體通入澄清石灰水,觀察有無白色渾濁 | |
| C. | 分別取樣配成溶液,滴加Ba(OH)2溶液,觀察有無白色沉淀 | |
| D. | 分別配成溶液,用鉑絲蘸取溶液在酒精燈火焰上灼燒,觀察火焰的顏色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 曲線①代表0.1 mol/L KOH溶液滴定HC1溶液的滴定曲線,曲線②代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲線 | |
| B. | 在相同溫度下,C點水電離的c(H+)等于A點水電離的c(H+) | |
| C. | 在A點的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L | |
| D. | 在B點的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有⑤ | B. | ①② | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅酸、氯化鐵溶液均為膠體 | B. | 水玻璃、堿石灰均為混合物 | ||
| C. | 硫酸、純堿、NaCl分別屬于酸、堿、鹽 | D. | KCl和Cu均屬于電解質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com