
過氧化銀(Ag2O2)是銀鋅堿性電池正極的活性物質,可通過下列反應制備:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一個相同的化學鍵,則該反應________ (填“是”或“不是”)氧化還原反應;已知下列反應:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反應中氧化劑與還原劑的物質的量之比為________。
(2)制備Ag2O2的反應進行完全后,經過濾、洗滌、干燥,即可得到Ag2O2,檢驗Ag2O2是否洗滌干凈的方法是________。
(3)一種銀鋅(Ag2O2、Zn)堿性電池的電解質溶液為KOH溶液,電池放電時正極生成Ag,負極只生成一種化合物(只含有Zn、K、H、O),其中Zn元素的質量分數為30%,鉀、鋅兩種元素的質量比為78?65,則該電池的總反應方程式為________。
(4)用銀鋅電池電解尿素[CO(NH2)2]的堿性溶液可制取H2,其裝置如圖所示(電解池中隔膜僅阻止氣體通過,M、N均為惰性電極)。

①N極與銀鋅電池的________(填“Zn”或“Ag2O2”)相連。
②M極的電極反應式為________________________。
(1)不是 5?2
(2)取少量最后一次洗滌液,滴加1~2滴硝酸酸化的Ba(NO3)2溶液,若不出現白色渾濁,則表明已洗滌干凈
(3)2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag
(4)①Zn ②CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
【解析】(1)根據題意可知,K2S2O8中含有過氧鍵,而生成物過氧化銀中也有過氧鍵,該反應中各元素化合價沒有發生變化,屬于非氧化還原反應。Mn2+與S2O82-的反應中,氧化劑是S2O82-,還原劑是Mn2+,根據其化合價變化值可知其物質的量之比為5?2。
(2)根據中學所學知識,檢驗SO42-即可,但不能使用BaCl2或Ba(OH)2,因為原反應物中含有Ag+。
(3)首先根據題意確定負極產物的化學式,設負極產物的化學式為K2ZnOxHy,則:65/30.8%=211,211-65-78=68,分析討論得x=y=4成立,故負極產物的化學式為K2Zn(OH)4。結合元素守恒可以寫出該電池的總反應式。
(4)①電解時,CO(NH2)2中N元素的化合價升高,發生氧化反應,所以CO(NH2)2在陽極放電,即M是陽極,應與原電池的正極(Ag2O2)相連;N極生成氫氣,必然是H+放電,發生還原反應,N是陰極,與原電池的負極(Zn)相連。②根據得失電子守恒、元素守恒和電荷守恒可寫出M極的電極反應式。
點撥:不少同學誤認為K2S2O8中O為-2價,S為+7價,實際上S的最高正價應該為+6價。


科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練 專題2化學常用計量練習卷(解析版) 題型:實驗題
過碳酸鈉俗稱固體雙氧水,是一種很好的消毒劑和供氧劑,化學式可表示為aNa2CO3·bH2O2,它具有Na2CO3和H2O2的雙重性質。現將一定質量的過碳酸鈉粉末溶于水配成稀溶液,再向其中加入適量的MnO2粉末,充分反應后生成672 mL氣體(標準狀況)。反應后的混合物經過濾、洗滌后,將濾液和洗滌液混合并加水配成100 mL溶液A。現向三份體積為10 mL、濃度為c的稀硫酸中分別逐滴滴入溶液A,邊滴邊振蕩,充分反應后,測得實驗數據如下表所示:
實驗序號 | Ⅰ | Ⅱ | Ⅲ |
滴加溶液A的體積/mL | 5.0 | 10.0 | 15.0 |
生成氣體的體積/mL(標準狀況) | 44.8 | 89.6 | 112 |
請回答下列問題:
(1)用化學方程式表示向過碳酸鈉溶液中加入MnO2粉末時放出氣體的原因:_______________________________________________________________。
(2)稀硫酸的物質的量濃度c=________ mol·L-1。
(3)通過計算可確定過碳酸鈉的化學式為________。
(4)工業上常以所含活性氧的質量分數 來衡量過碳酸鈉產品的優劣,13%以上者為優等品。
來衡量過碳酸鈉產品的優劣,13%以上者為優等品。
現將0.2 g某廠家生產的過碳酸鈉樣品(所含雜質不參與后面的氧化還原反應)溶于水配成溶液,加入15.0 mL 1 mol·L-1硫酸,再加入足量KI,搖勻后置于暗處,充分反應后,加入少量淀粉試液,用0.1 mol·L-1 Na2S2O3溶液滴定到藍色恰好消失時,共消耗33.00 mL,請通過計算判斷該樣品是否為優等品(要求寫出計算過程)。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 離子反應、氧化還原反應練習卷(解析版) 題型:填空題
某溶液可能含有Na+、K+、Mg2+、Cu2+等陽離子及MnO4—、SiO32—、AlO2—、CO32—、HCO3—、SO42—、Cl-等陰離子,已知:①該溶液呈無色;②經測定溶液的pH=12;③取少量溶液,加入100 mL 2 mol·L-1稀鹽酸進行酸化,有白色沉淀生成,還得到一種無色無味的氣體,該氣體使澄清石灰水(足量)變渾濁。對酸化后的溶液過濾,得到濾液甲。
(1)由①②③可判斷:原溶液中一定不存在的離子是________,一定存在的離子是________。
(2)將濾液甲分成兩等份,一份中逐滴加入氨水、最終有白色膠狀沉淀,說明原溶液中一定有________(填離子符號),剛開始加入氨水時,沒有沉淀產生,原因是____________________________________(用離子方程式表示);另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,說明原溶液中一定有________(填離子符號),過濾得到濾液乙。
(3)往濾液乙中加入足量的AgNO3溶液,過濾、洗滌、干燥得固體26.5 g,則原溶液中是否有Cl-?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 電解質溶液練習卷(解析版) 題型:選擇題
下列說法正確的是( )
A.反應2Mg+CO2 2MgO+C ΔH<0從熵變角度看,可以自發進行
2MgO+C ΔH<0從熵變角度看,可以自發進行
B.在密閉容器發生可逆反應:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,達到平衡后,保持溫度不變,縮小容器體積,重新達到平衡后,ΔH變小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,達到平衡后,保持溫度不變,縮小容器體積,重新達到平衡后,ΔH變小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,將等體積的濃度為1.0×10-4mol/L的AgNO3溶液滴入到濃度均為1.0×10-4mol/L的KCl和K2CrO4的混合溶液中產生兩種不同沉淀,且Ag2CrO4沉淀先產生
D.根據HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推測相同狀況下,等濃度的NaClO與Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 電解質溶液練習卷(解析版) 題型:選擇題
室溫下,將一元酸HA的溶液和KOH溶液等體積混合(忽略體積變化),實驗數據如下表:
實驗編號 | 起始濃度/(mol·L-1) | 反應后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判斷不正確的是( )
A.實驗①反應后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.實驗①反應后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
C.實驗②反應后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.實驗②反應后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 電化學原理及其應用練習卷(解析版) 題型:選擇題
“神舟九號”與“天宮一號”成功對接,是我國載人航天事業發展走向成熟的一個標志。空間實驗室“天宮一號”的供電系統為再生氫氧燃料電池(RFC),RFC是一種將水電解技術與氫氧燃料電池技術相結合的可充電電池。如圖為RFC工作原理示意圖,下列有關說法正確的是( )

A.圖甲把化學能轉化為電能,圖乙把電能轉化為化學能,水得到了循環使用
B.當有0.1 mol電子轉移時,a極產生0.56 L O2(標準狀況下)
C.c極上發生的電極反應是O2+4H++4e-=2H2O
D.圖乙中電子從c極流向d極,提供電能
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構與性質練習卷(解析版) 題型:填空題
A、B、C、E、F為原子序數依次增大的六種元素,其中A、B、C、D、E為短周期元素,F為第四周期元素,F還是前四周期中電負極最小的元素。
已知:
A原子的核外電子數與電子層數相等;
B元素原子的核外p電子數比s電子數少1個;
C原子的第一至第四電離能為I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p軌道為全充滿或半充滿;
E元素的族序數與周期序數的差為4;
(1)寫出E元素在周期表位置:________;D元素的原子的核外電子排布式:____________________。
(2)某同學根據題目信息和掌握的知識分析C的核外電子排布為
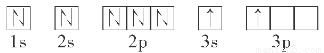
該同學所畫的軌道式違背了________。

(3)已知BA5為離子化合物,寫出其電子式:______________。
(4)DE3中心原子雜化方式為__________________,其空間構型為______________。
(5)某金屬晶體中原子堆積方式如圖甲,晶胞特征如圖乙,原子相對位置關系如圖丙,則晶胞中該原子配位數為________;空間利用率為________;該晶體的密度為________。(已知該金屬相對原子質量為m,原子半徑為a cm)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構、元素周期律練習卷(解析版) 題型:填空題
A、B、C、D、E、F均為短周期主族元素,且原子序數依次增大。短周期元素中C的原子半徑最大,B、E同族,E的最外層電子數是電子層數的2倍,A的最高價氧化物水化物為H2AO3,D是地殼中含量最高的金屬元素。
(1)A的元素符號是________,C2B2的電子式為________。
(2)B、C、D、F的離子半徑由大到小的順序是________(用離子符號表示)。
(3)E和F相比,非金屬性強的是________(用元素符號表示),下列事實能證明這一結論的是________(用符號填空)。
①常溫下E的單質呈固態,F的單質呈氣態 ②氣態氫化物的穩定性:F>E ③E和F形成的化合物中,E顯正價 ④F單質能與E的氫化物發生置換反應 ⑤E和F的氧化物的水化物的酸性強弱 ⑥氣態氫化物的還原性:E>F
(4)把CDB2溶液蒸干所得的固體物質為________(填化學式)。
(5)C和F可組成化合物甲,用惰性電極電解甲的水溶液,電解的化學方程式為__________________________。
(6)A、B、C三種元素組成的常見化合物乙的溶液中,離子濃度由大到小的順序為________,pH=10的乙溶液中由水電離產生的c(OH-)=________mol·L-1。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 有機化學基礎練習卷(解析版) 題型:選擇題
某有機物結構簡式為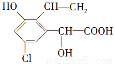 ,下列關于該有機物的說法中不正確的是( )
,下列關于該有機物的說法中不正確的是( )
A.遇FeCl3溶液顯紫色
B.與足量的氫氧化鈉溶液在一定條件下反應,最多消耗NaOH 3 mol
C.能發生縮聚反應和加聚反應
D.1 mol該有機物與溴發生加成反應,最多消耗1 mol Br2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com