
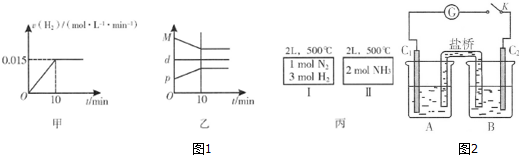
 氮的固定是指將氮元素由游離態轉化為化合態的過程.
氮的固定是指將氮元素由游離態轉化為化合態的過程.| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
分析 Ⅰ.(1)a變化0.2mol,b變化0.4mol,二者物質的量之比為1:2,則a為氮氣、b為氨氣,由方程式可知氫氣變化量為0.2mol×3=0.6mol,再根據v=$\frac{△c}{△t}$計算;
(2)實驗室用氯化銨與熟石灰制備氨氣,反應生成氯化鈣、氨氣與水;
Ⅱ.(1)閃電或者高溫,主要是提供能量給N2分子,讓其破壞變成氮原子,因此,只能說明引發反應所需要的能量高即活化能,不能說明反應吸收的能量高;
(2)由表中數據可知,隨溫度升高平衡常數增大,說明升高溫度平衡向正反應方向移動;
Ⅲ.總反應式為:N2+3H2?2NH3,在電解法合成氨的過程中,陽極發生氧化反應,陰極發生還原反應,在陽極通入H2,氮氣通入陰極,氮氣得電子發生還原反應,與通過質子交換膜的氫離子結合生成氨氣;
Ⅳ.(1)平衡常數指生成物平衡濃度化學計量數冪乘積與反應物平衡濃度化學計量數冪乘積的比;
(2)反應相同時間,低溫下的兩點是未達到平衡的兩點,隨溫度的升高,氮氣的體積分數增大,曲線的最高點是某溫度下達到平衡的點,之后的兩點,皆是平衡后的氮氣的體積分數,且隨溫度升高而降低,平衡向逆反應移動,則正反應為放熱反應.
解答 解:Ⅰ.(1)a變化0.2mol,b變化0.4mol,二者物質的量之比為1:2,則a為氮氣、b為氨氣,由方程式可知氫氣變化量為0.2mol×3=0.6mol,則15分鐘內的反應速率為v(H2)=$\frac{\frac{0.6mol}{2L}}{15min}$=0.02mol/(L•min),
故答案為:0.02mol/(L•min);
(2)實驗室用氯化銨與熟石灰制備氨氣,反應生成氯化鈣、氨氣與水,反應方程式為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
Ⅱ.(1)閃電或者高溫,主要是提供能量給N2分子,讓其破壞變成氮原子,因此,只能說明引發反應所需要的能量高即活化能,不能說明反應吸收的能量高,
故答案為:A;
(2)在不同溫度下,反應N2(g)+O2(g)?2NO(g)的平衡常數K隨溫度升高增大,說明升高溫度平衡向正反應方向移動,所以正反應方向是吸熱反應,△H>0,
故答案為:>;
Ⅲ.總反應式為:N2+3H2?2NH3,在電解法合成氨的過程中,陽極發生氧化反應,陰極發生還原反應,在陽極通入H2,氮氣通入陰極,氮氣得電子發生還原反應,與通過質子交換膜的氫離子結合生成氨氣,電極反應式為:N2+6H++6e-=2NH3,
故答案為:陽極;N2+6H++6e-=2NH3;
Ⅳ.(1)2N2(g)+6H2O (g)?4NH3(g)+3O2(g)平衡常數表達式K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$,
故答案為:$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$;
(2)反應相同時間,低溫下的兩點是未達到平衡的兩點,隨溫度的升高,氮氣的體積分數增大,曲線的最高點是某溫度下達到平衡的點,之后的兩點,皆是平衡后的氮氣的體積分數,且隨溫度升高而降低,平衡向逆反應移動,則正反應為放熱反應,即Q<0,
故答案為:<.
點評 本題考查化學平衡計算與影響因素、反應速率計算、化學平衡常數、電解原理應用等,側重考查學生分析解決問題的能力,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 有1.25mol NaN3被氧化 | B. | 被還原的N原子的數目是0.2NA | ||
| C. | 轉移電子的物質的量為2mol | D. | 標準狀況下生成44.8L N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易與水強烈反應,空氣中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
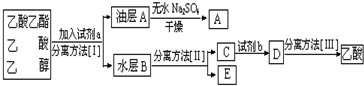
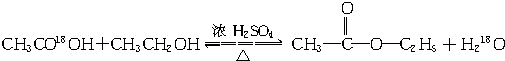 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO) | c(H2) | c(CH3OH) | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
 VO2++V3++H2O,試推寫出放電時正極的電極反應式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,試推寫出放電時正極的電極反應式VO2++2H++e-=VO2++H2O. Mg2++2OH-,當加入Fe3+后與OH-生成更難溶解的Fe(OH)3,使平衡繼續向右移動,最后Mg(OH)2全部溶解轉化為紅棕色的Fe(OH)3.
Mg2++2OH-,當加入Fe3+后與OH-生成更難溶解的Fe(OH)3,使平衡繼續向右移動,最后Mg(OH)2全部溶解轉化為紅棕色的Fe(OH)3.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
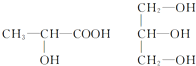 按要求完成下列問題.
按要求完成下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油和植物油都是混合物,且屬于不同類的有機物 | |
| B. | 甲酸的性質與乙酸類似,都不能被酸性高錳酸鉀溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鑒別乙醇與乙醛溶液 | |
| D. | 纖維素、蔗糖、葡萄糖和淀粉酶在一定條件下都可發生水解反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com