
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀釋10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液與pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三種溶液中c(Na+):①>②>③ |
分析 A.任何電解質溶液中都存在電荷守恒,根電荷守恒判斷;
B.乙酸是弱電解質,加水稀釋促進弱電解質電離;
C.任何電解質溶液中都存在電荷守恒,根據電荷守恒判斷;
D.弱酸根離子水解程度越大,pH相同的鈉鹽溶液濃度越小.
解答 解:A.任何電解質溶液中都存在電荷守恒,根據電荷守恒得c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故A錯誤;
B.乙酸是弱電解質,加水稀釋促進弱電解質電離,所以醋酸溶液稀釋10倍后,氫離子濃度大于原來的$\frac{1}{10}$,所以pH=x的CH3COOH溶液100mL,稀釋10倍后pH=y,x-y>-1,故B錯誤;
C.任何電解質溶液中都存在電荷守恒,根據電荷守恒得c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故C正確;
D.弱酸根離子水解程度越大,pH相同的鈉鹽溶液濃度越小,酸根離子水解程度CO32->ClO->CH3COO-,所以pH相同的①CH3COONa、②Na2CO3 、③NaClO三種溶液中c(Na+):①>③>②,故D錯誤.
故選C.
點評 本題考查離子濃度大小比較,為高考高頻點,明確溶液中溶質及其性質是解本題關鍵,知道弱電解質電離特點,注意結合電荷守恒、物料守恒分析,易錯選項是D.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
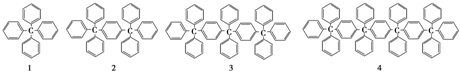
| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S和KNO3都是反應的氧化劑 | B. | C在反應中得電子 | ||
| C. | CO2是反應的氧化產物 | D. | K2S和N2都是反應的還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該化合物含有離子鍵和共價鍵 | |
| B. | 1molO2參與該反應時,得到1mol電子 | |
| C. | 該化合物中陽離子與陰離子個數比為2:1 | |
| D. | O2PtF6的熔點可能比O2低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
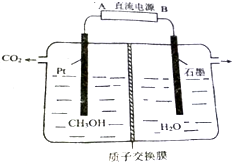 工業(yè)廢水中的甲醇也可用電化學方法處理,原理如圖所示.
工業(yè)廢水中的甲醇也可用電化學方法處理,原理如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
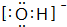
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 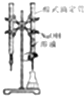 如圖裝置可用于已知濃度的氫氧化鈉溶液滴定未知濃度的鹽酸 | |
| B. |  如圖裝置可用于氯化銨固體和氫氧化鈣固體反應制取少量氨氣 | |
| C. | 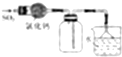 如圖裝置可用于收集SO2,并吸收多余的SO2 | |
| D. | 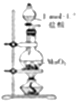 如圖裝置可用于制取少量Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強酸和強堿的中和反應的活化能接近于零,所以反應速率很高 | |
| B. | 過程的自發(fā)性既能用于判斷過程的方向,也能用于判斷過程發(fā)生的速率 | |
| C. | 電解質溶液導電的過程中,一定發(fā)生了電解質溶液的電解 | |
| D. | 溶解度較小的BaSO4在一定條件下也可以轉化為溶解度略大的BaCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相對分子質量相等的兩種物質,不一定是同分異構體 | |
| D. | 烯烴各同系物含碳的質量分數相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com