
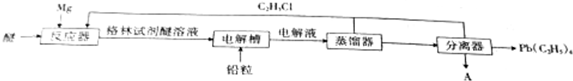
 ,電解物質A的化學方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑.
,電解物質A的化學方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑.分析 (1)鎂和二氧化碳反應生成碳和氧化鎂,用鎂屑代替鎂塊,可以增大反應物接觸面積,加快反應速率,但反應速率不能太快且鎂粉在空氣中容易被氧氣氧化,所以不宜用鎂粉;
(2)陽極參與電極反應的是格林試劑和鉛,是鉛失去電子生成Pb(C2H5)4,根據元素守恒和電荷守恒書寫電極反應式;
(3)根據元素守恒和電荷守恒可知,電解槽中發生的反應為Pb+4C2H5MgCl$\frac{\underline{\;電解\;}}{\;}$Pb(C2H5)4+2Mg+2MgCl2,所以從分離器中分離出來的物質A為MgCl2,電解MgCl2生成鎂和氯氣;
(4)根據反應C2H5Cl+Mg$\stackrel{無水乙醚}{→}$C2H5MgCl、Pb+4C2H5MgCl$\frac{\underline{\;電解\;}}{\;}$Pb(C2H5)4+2Mg+2MgCl2,可知開始投入的Pb和Mg的物質的量之比;
(5)四乙基鉛燃燒即與氧氣反應生成生成一氧化鉛、二氧化碳和水,根據元素守恒書寫化學方程式;
解答 解:(1)鎂和二氧化碳反應生成碳和氧化鎂,反應方程式為CO2+2Mg$\frac{\underline{\;點燃\;}}{\;}$C+2MgO,用鎂屑代替鎂塊,可以增大反應物接觸面積,加快反應速率,但反應速率不能太快且鎂粉在空氣中容易被氧氣氧化,所以不宜用鎂粉,
故答案為:CO2+2Mg$\frac{\underline{\;點燃\;}}{\;}$C+2MgO;增大反應物接觸面積,加快反應速率;用鎂粉反應速率太快且鎂粉在空氣中容易被氧氣氧化;
(2)陽極參與電極反應的是格林試劑和鉛,是鉛失去電子生成Pb(C2H5)4,陽極的電極反應式為Pb-4e-+4C2H5MgCl=Pb(C2H5)4+4Mg2++4Cl-,
故答案為:Pb-4e-+4C2H5MgCl=Pb(C2H5)4+4Mg2++4Cl-;
(3)根據元素守恒和電荷守恒可知,電解槽中發生的反應為Pb+4C2H5MgCl$\frac{\underline{\;電解\;}}{\;}$Pb(C2H5)4+2Mg+2MgCl2,所以從分離器中分離出來的物質A為MgCl2,其電子式為: ,電解MgCl2生成鎂和氯氣,反應方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑,
,電解MgCl2生成鎂和氯氣,反應方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑,
故答案為: ;MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑;
;MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑;
(4)根據反應C2H5Cl+Mg$\stackrel{無水乙醚}{→}$C2H5MgCl、Pb+4C2H5MgCl$\frac{\underline{\;電解\;}}{\;}$Pb(C2H5)4+2Mg+2MgCl2,可知開始投入的Pb和Mg的物質的量之比為1:4,
故答案為:1:4;
(5)四乙基鉛燃燒即與氧氣反應生成生成一氧化鉛、二氧化碳和水,反應化學方程式為2Pb(C2H5)4+27O2$\frac{\underline{\;點燃\;}}{\;}$2PbO+16CO2+20H2O,
故答案為:2Pb(C2H5)4+27O2$\frac{\underline{\;點燃\;}}{\;}$2PbO+16CO2+20H2O;
點評 本題主要考查了物質制備實驗,涉及方程式的書寫、電極反應式的書寫、電子式等,正確理解流程是解題關鍵,答題時注意應用元素守恒 和電荷守恒的思想,題目難度中等,側重化學基礎知識和基本能力的考查.


 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
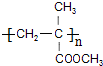 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
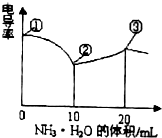
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
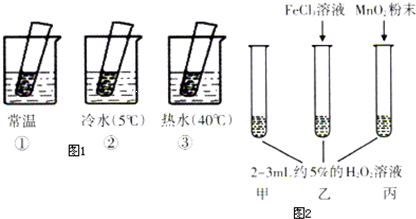
| 現象 | 結論 | |
| 熱水中 | 溶液中有氣泡產生,比常溫快 | 升高溫度,H2O2的分解速率加快 |
| 常溫中 | 溶液中有氣泡產生,且速度較快 | 無 |
| 冷水中 | 溶液中有氣泡產生,比常溫慢 | 降低溫度,H2O2的分解速率減慢 |
| 現象 | 結論 | |
| 丙加入MnO2 | MnO2能加快化學反應速率 | |
| 乙加入FeCl3 | FeCl3能加快化學反應速率 | |
| 甲不加其他試劑 | 溶液中有少量氣泡出現 | 不使用催化劑化學反應速率較小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaAlO2 和 HCl | B. | MgCl2和 NH3•H2O | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 冰鎮的啤酒打開后泛起泡沫 | |
| B. | 500℃左右比室溫更有利于合成氨的反應(△H<0) | |
| C. | 紅棕色的NO2加壓后顏色先變深再變淺(2 NO2?N2O4(無色)) | |
| D. | 光照新制的氯水時,溶液的pH逐漸減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LH2O含有的分子數為1 NA | |
| B. | 常溫常壓下,1molNa2CO3含有的Na+離子數為2 NA | |
| C. | 通常狀況下,1 NA 個CO2分子占有的體積為22.4L | |
| D. | 1mol/L的MgCl2溶液中,含有Cl- 個數為2 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com