
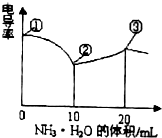
分析 (1)圖象中①為未加NH3•H2O時的HCl和CH3COOH混合液,②NH3•H2O恰好和HCl完全反應生成氯化銨;③NH3•H2O和HCl、CH3COOH恰好完全反應生成氯化銨和醋酸銨;
(2)①-②段為HCl和NH3•H2O的反應、②-③為NH3•H2O和CH3COOH的反應;
(3)酸或堿抑制水電離,含有弱離子的鹽促進水電離,酸中氫離子濃度越大其抑制水電離程度越大.
解答 解:(1)圖象中①為未加NH3•H2O時的HCl和CH3COOH混合液,該點溶液中溶質為HCl和CH3COOH,且n(HCl)=n(CH3COOH)=0.100mol/L×0.01L=0.001mol;
②NH3•H2O恰好和HCl完全反應生成NH4Cl,CH3COOH未反應,所以溶質為NH4Cl、CH3COOH,根據Cl原子守恒得n(NH4Cl)=n(HCl)=0.001mol,n(CH3COOH)=0.001mol;
③NH3•H2O和HCl、CH3COOH恰好完全反應生成氯化銨和醋酸銨,溶質為氯化銨和醋酸銨,根據Cl、C原子守恒得n(NH4Cl)=n(CH3COONH4)=0.001mol,
故答案為:①點溶質為HCl和CH3COOH,n(HCl)=n(CH3COOH)=0.001mol;
②點溶質為NH4Cl、CH3COOH,且n(NH4Cl)=n(CH3COOH)=0.001mol;
③點位置的溶質成氯化銨和醋酸銨,n(NH4Cl)=n(CH3COONH4)=0.001mol;
(2)①-②段為HCl和NH3•H2O的反應、②-③為NH3•H2O和CH3COOH的反應,
其離子方程式分別為H++NH3.H2O=NH4++H2O、CH3COOH+NH3.H2O=NH4++CH3COO-+H2O,
故答案為:H++NH3.H2O=NH4++H2O; CH3COOH+NH3.H2O=NH4++CH3COO-+H2O;
(3)酸或堿抑制水電離,含有弱離子的鹽促進水電離,酸中氫離子濃度越大其抑制水電離程度越大,①點溶質為酸、②點溶質為氯化銨和醋酸、③點溶質為氯化銨和醋酸銨,且酸性①>②,所以①、②、③水的電離程度大小順序是③>②>①,
故答案為:③>②>①.
點評 本題考查酸堿混合溶液定性判斷,為高頻考點,明確各點發生的反應及溶液中溶質成分、物質的量是解本題關鍵,注意:水的電離程度與溶液溶質成分及氫離子或氫氧根離子濃度大小有關,題目難度不大.


科目:高中化學 來源: 題型:解答題

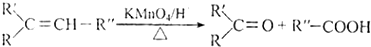
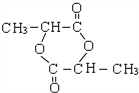
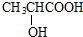 +HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O
+HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O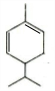 ,A與等物質的量的Br2進行加成反應的產物共有3種.(不考慮立體異構)
,A與等物質的量的Br2進行加成反應的產物共有3種.(不考慮立體異構)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,向1L 0.10mol•L-1 CH3COOH溶液中通人HCl至溶液pH=7時溶液中氯離子與醋酸根離子的微粒數目之和為0.2NA | |
| B. | 25℃時,1L pH=12的NaOH溶液中,由水電離的H+數目為0.01NA | |
| C. | 氫氧燃料電池負極消耗22.4L(標準狀況)氣體時,電路中通過的電子數目為2NA | |
| D. | H2SO4(濃)+H2S=SO2↑+S↓+2H2O反應中,生成64gSO2時,轉移的電子數目為6NA. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
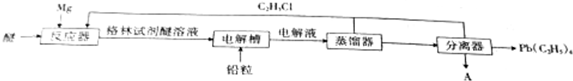
 ,電解物質A的化學方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑.
,電解物質A的化學方程式為MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷分子的球棍模型: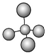 | B. | NH4Br的電子式: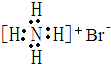 | ||
| C. | 34S2-的結構示意圖: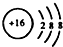 | D. | 鄰羥基甲苯酸的結構簡式: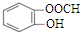 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 mol•L-1 | B. | 0.2mol•L-1 | C. | 2 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com