
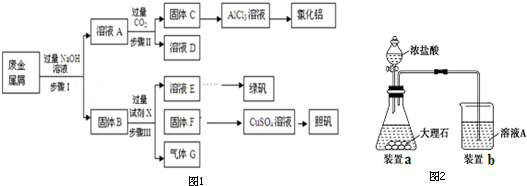
 已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.分析 (1)①CH3COOH是弱電解質,HCl是強電解質,等濃度的兩種溶液中鹽酸中c(H+)大于CH3COOH;
②溶液的導電能力與離子濃度成正比;
③酸抑制水電離,酸中氫離子濃度越大,其抑制程度越大;
④中和等物質的量的NaOH溶液,消耗酸的體積與酸的濃度成反比;
(2)根據醋酸的電離平衡CH3COOH?H++CH3COO-和電荷守恒來計算;
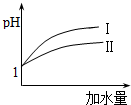
(3)pH相等的醋酸和鹽酸中,加水稀釋促進醋酸電離,導致稀釋相同的倍數時,醋酸的pH大于HCl;
(4)混合溶液呈中性,則c(H+)=c(OH-),醋酸鈉是強堿弱酸鹽,其溶液呈堿性,要使混合溶液呈中性,則醋酸應該稍微過量;
(5)25℃時,若向氨水中加入稀鹽酸至溶液的pH=7,溶液呈中性說明氫離子和氫氧根的濃度一定相等,根據電荷守恒來判斷離子濃度大小.
解答 解:(1)①CH3COOH是弱電解質,HCl是強電解質,等濃度的兩種溶液中鹽酸中c(H+)大于CH3COOH,所以醋酸的pH大于HCl,故①錯誤;
②CH3COOH是弱電解質,HCl是強電解質,等濃度的兩種溶液中鹽酸中離子濃度大于醋酸,溶液的導電能力與離子濃度成正比,所以HCl溶液的導電能力強,故②錯誤;
③酸抑制水電離,酸中氫離子濃度越大,其抑制程度越大,等濃度的兩種酸中,HCl中氫離子濃度大于醋酸,所以由水電離出的c(OH-)醋酸大于鹽酸,故③錯誤;
④中和等物質的量的NaOH溶液,消耗酸的體積與酸的濃度成反比,兩種酸的物質的量濃度相等,所以需要酸的體積相等,故④正確;
故答案為:④;
(2)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,則c(OH-)=10-9mol/L,根據醋酸溶液中電荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),可以看出,c(CH3COO-)=c(H+)-c(OH-)=(10-5-10-9)mol/L,
故答案為:(10-5-10-9)mol/L;
(3)pH相等的醋酸和鹽酸中,加水稀釋促進醋酸電離,導致稀釋相同的倍數時,醋酸的pH大于HCl,根據圖象知,Ⅰ是HCl變化曲線,
故答案為:Ⅰ;
(4)醋酸溶液是弱酸,pH為3的醋酸溶液中,醋酸的濃度大于10-3mol/L,pH=11的NaOH溶液濃度等于10-3mol/L,最后溶液恰好呈中性,則氫氧化鈉溶液的體積稍大些,即:Va<Vb,
故答案為:<;
(5)混合溶液呈中性,則c(H+)=c(OH-),再根據電荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知:c(Cl-)=c(NH4+)=amol/L,
故答案為:amol/L.
點評 本題考查了弱電解質的電離,題目難度中等,根據電解質電離特點結合鹽類水解等知識點來分析解答,注意溶液的導電性與離子濃度有關,與電解質強弱無關,為易錯點.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定溫度下,將一定質量的冰醋酸加水稀釋過程中,溶液的導電能力變化如圖所示.下列有關a、b、c三點的說法中正確的是( )
一定溫度下,將一定質量的冰醋酸加水稀釋過程中,溶液的導電能力變化如圖所示.下列有關a、b、c三點的說法中正確的是( )| A. | 醋酸的電離程度由大到小的順序:b>c>a | |
| B. | 溶液的pH由大到小的順序:a>c>b | |
| C. | 用濕潤的pH試紙測量醋酸溶液的pH,測量結果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的數值不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
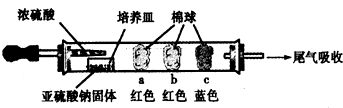
| 棉球 | 棉球上滴加的試劑 | 實驗現象 | 解釋和結論 |
| a | 品紅試液 | 棉球變白,微熱后又恢復紅色 | SO2具有漂白性,且為暫時性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球變為白色 | 離子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球變為白色 | 該氣體具有還原性 (選填“氧化性”或“還原性”) |
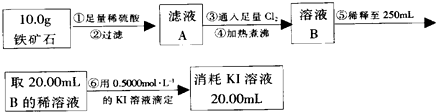
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
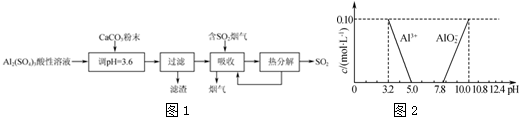
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知某密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物質的量濃度c(CO2)與溫度t的關系如圖所示.下列說法錯誤的是( )
已知某密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物質的量濃度c(CO2)與溫度t的關系如圖所示.下列說法錯誤的是( )| A. | 平衡狀態A與C相比,平衡狀態A的c(CO)較小 | |
| B. | 在t2時,D點的反應速率:ν(逆)>ν(正) | |
| C. | 反應CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2時的平衡常數分別為K1、K2,則K1<K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
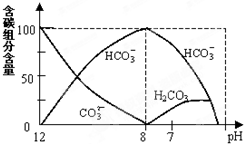 在含有弱電解質的溶液中,往往有多個化學平衡共存
在含有弱電解質的溶液中,往往有多個化學平衡共存查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醫用酒精的濃度通常為95% | |
| B. | 淀粉、纖維素和油脂都屬于天然高分子化合物 | |
| C. | 將水壩的鋼鐵閘門與直流電的正極相連可以防閘門腐蝕 | |
| D. | 硫酸亞鐵片和維生素C同時服用,能增強治療缺鐵性貧血的效果 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com