
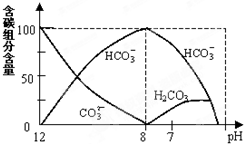
 在含有弱電解質的溶液中,往往有多個化學平衡共存
在含有弱電解質的溶液中,往往有多個化學平衡共存分析 (1)常溫下,將0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等體積混合后,得到溶液溶質為NaA和HA,溶液pH大于7,說明A-離子水解程度大于HA電離程度;
(2)常溫下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反應生成碳酸氫鈉,再與鹽酸反應生成二氧化碳、水,以此分析解答.
解答 解:(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等體積混合后,反應后得到等量的HA、NaA,溶液pH大于7,則鹽類水解大于酸的電離,
A. 水解生成HA,則c(HA)>c(A-),故A錯誤;
B.因等體積混合,則反應后c(HA)一定小于0.1mol/L,故B錯誤;
C.反應后得到等量的HA、NaA,則2c(Na+)=c(HA)+c(A-),故C錯誤;
D.由電荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),則c(OH-)=c(H+)+$\frac{1}{2}$[c(HA)-c(A-)],故D正確;
故答案為:D;
(2)常溫下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反應生成碳酸氫鈉,再與鹽酸反應生成二氧化碳、水,
①由反應及圖象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案為:不能;
②當pH=7時,溶液中溶質為碳酸氫鈉、氯化鈉,離子濃度大小為:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
故答案為:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
③水解常數Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,當溶液中c(HCO3-):c(CO32-)=2:1時,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,
故答案為:10.
點評 本題考查較綜合,涉及溶液中離子濃度大小分析,化學平衡常數的計算及溶液中酸堿之間的反應,題目難度較大,綜合考查學生分析問題、解決問題的能力,注重能力的考查.


科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH溶液中離子濃度的關系滿足:c(H+)=c(OH-)+c(CH3COO?) | |
| B. | 常溫下,pH=2的CH3COOH溶液與pH=12的NaOH 溶液等體積混合后溶液的pH=7 | |
| C. | CH3COOH溶液中加入少量CH3COONa固體.平衡逆向移動 | |
| D. | 室溫下向pH=3的醋酸溶液中加水稀釋,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某吸熱反應能自發進行,因此該反應是熵增反應 | |
| B. | 加入NaHCO3使氯水的漂白能力增強 | |
| C. | 難溶電解質可以由溶解度小的轉化為溶解度更小的,但不能從溶解度小的轉化為溶解度大的 | |
| D. | Ksp只受溫度的影響,不受濃度的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
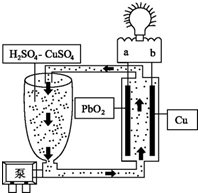 流動電池是一種新型電池.其主要特點是可以通過電解質溶液的循環流動,在電池外部調節電解質溶液,以保持電池內部電極周圍溶液濃度的穩定.我國某研究小組新開發的一種流動電池如圖所示,電池總反應為Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列說法不正確的是( )
流動電池是一種新型電池.其主要特點是可以通過電解質溶液的循環流動,在電池外部調節電解質溶液,以保持電池內部電極周圍溶液濃度的穩定.我國某研究小組新開發的一種流動電池如圖所示,電池總反應為Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列說法不正確的是( )| A. | a為正極,b為負極 | |
| B. | 該電池工作時PbO2電極附近溶液的pH增大 | |
| C. | b極的電極反應為Cu-2e-═Cu2+ | |
| D. | 調節電解質溶液的方法是補充CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 CH3COOCH2CH3+H2O,酯化反應或取代反應.
CH3COOCH2CH3+H2O,酯化反應或取代反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com