
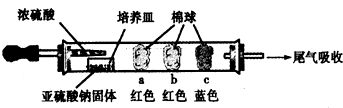
| 棉球 | 棉球上滴加的試劑 | 實驗現象 | 解釋和結論 |
| a | 品紅試液 | 棉球變白,微熱后又恢復紅色 | SO2具有漂白性,且為暫時性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球變為白色 | 離子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球變為白色 | 該氣體具有還原性 (選填“氧化性”或“還原性”) |
分析 I.a二氧化硫具有漂白性,但其漂白性不穩定,加熱時會恢復為原來的顏色;
b.二氧化硫屬于酸性氧化物,能和強堿反應生成鹽和水;
c.二氧化硫具有還原性,能和碘發生氧化還原反應;
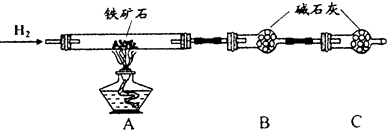
II.實驗一:鐵礦石中含氧量的測定
(3)在氫氣還原金屬氧化物時,在點燃酒精燈前要驗純;
(5)反應后裝置B增重2.7g,即氫氣和氧化鐵反應后固體質量的增加值,可以根據差量法來計算;
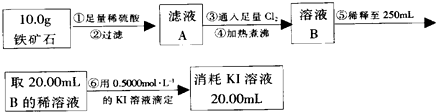
實驗二:(1)根據過濾、稀釋液體和配制一定體積的溶液所選擇的儀器來回答;
(2)根據滴定實驗以及滴定過程中的實驗誤差分析知識判斷;
根據碘元素計算鐵元素的質量分數,再根據鐵元素質量分數和氧元素質量分數計算出鐵的氧化物的化學式.
解答 解:I.a.紅色棉球變白,微熱后又恢復紅色,說明二氧化硫使品紅溶液褪色,則棉球上滴有品紅溶液,該實驗說明二氧化硫具有漂白性,但其漂白性不穩定,
故填:品紅溶液;二氧化硫具有漂白性,為暫時性漂白;
b.二氧化硫屬于酸性氧化物,能和NaOH溶液反應生成亞硫酸鈉和水或亞硫酸氫鈉,導致溶液堿性減弱,所以棉球變為白色,離子方程式為:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ
故填:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉試液變藍色,二氧化硫具有還原性,碘具有氧化性,二者反應生成氫碘酸和硫酸,所以棉球變為白色,離子方程式為:SO2+I2+2H2O=4H++SO42-+2I-,該實驗說明二氧化硫具有還原性,
故填:含淀粉的碘水;還原性;
故答案為:
| 棉球 | 棉球上滴加的試劑 | 現象 | 解釋和結論 |
| a | 品紅試液 | SO2具有漂白性,且為暫時性漂白 | |
| b | 2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ | ||
| c | 含淀粉的碘水 | 還原性 |
點評 本題考查了探究鐵礦石中鐵和氧元素的含量、二氧化硫的性質,二氧化硫具有還原性、氧化性、漂白性,根據二氧化硫的這幾個性質分析解答;鐵礦石中成分及其含量的測定中,根據物質的形成從整體上把握知識點,同時考查學生分析問題、解決問題的能力,題目難度中等.


 學練快車道快樂假期寒假作業系列答案
學練快車道快樂假期寒假作業系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗原理 | m=cVM |
| 實驗儀器 | 托盤天平、藥匙、燒杯、玻璃棒、100mL容量瓶、膠頭滴管 |
| 實驗步驟 | (1)計算:溶質NaCl固體的質量為11.7g. (2)稱量:用托盤天平稱取所需NaCl固體. (3)溶解:將稱好的NaCl固體放入燒杯中,用適量蒸餾水攪拌. (4)轉移、洗滌:將燒杯中的溶液注入容量瓶中,并用少量蒸餾水洗滌燒杯內壁2~3次,洗滌液也都注入容量瓶中. (5)定容:將蒸餾水注入儀器至液面離刻度線1~2cm時,改用 膠頭滴管滴加蒸餾水至液面與刻度線相切. (6)搖勻:蓋好瓶塞,反復上下顛倒,然后靜置. |
| 思考與探究 | (7)某同學在實驗步驟(6)后,發現凹液面低于刻度線,于是再向容器中滴加蒸餾水至刻度線,該同學所配置溶液是濃度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和鹽酸是日常生活中極為常見的酸,在一定條件下,CH3COOH溶液中存在電離平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
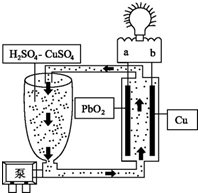 流動電池是一種新型電池.其主要特點是可以通過電解質溶液的循環流動,在電池外部調節電解質溶液,以保持電池內部電極周圍溶液濃度的穩定.我國某研究小組新開發的一種流動電池如圖所示,電池總反應為Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列說法不正確的是( )
流動電池是一種新型電池.其主要特點是可以通過電解質溶液的循環流動,在電池外部調節電解質溶液,以保持電池內部電極周圍溶液濃度的穩定.我國某研究小組新開發的一種流動電池如圖所示,電池總反應為Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列說法不正確的是( )| A. | a為正極,b為負極 | |
| B. | 該電池工作時PbO2電極附近溶液的pH增大 | |
| C. | b極的電極反應為Cu-2e-═Cu2+ | |
| D. | 調節電解質溶液的方法是補充CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
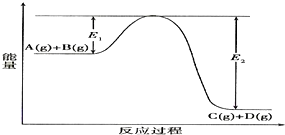
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com