
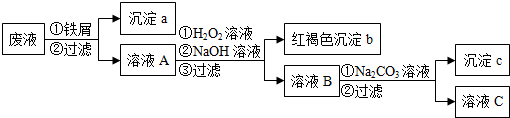
分析 某酸性廢液中加入鐵粉鐵離子、銅離子和氫離子與鐵反應生成深沉a是鐵與銅,溶液A中含有亞鐵離子和鋇離子,然后加入過氧化氫將亞鐵轉化為鐵離子,調節溶液PH使鐵離子轉化為氫氧化鐵沉淀完全,所以沉淀b是氫氧化鐵,溶液B中含鋇離子、鈉離子和氫氧根離子,加入碳酸鈉生成碳酸鋇沉淀,由此分析解答;
(1)加鐵屑后發生的離子反應有鐵離子、銅離子和氫離子與鐵反應;
(2)沉淀a中含有的單質是鐵和銅;
(3)沉淀c的化學式是碳酸鋇;
(4)H2O2與Fe2+在酸性條件下反應生成鐵離子、水.
解答 解:某酸性廢液中加入鐵粉鐵離子、銅離子和氫離子與鐵反應生成深沉a是鐵與銅,溶液A中含有亞鐵離子和鋇離子,然后加入過氧化氫將亞鐵轉化為鐵離子,調節溶液PH使鐵離子轉化為氫氧化鐵沉淀完全,所以沉淀b是氫氧化鐵,溶液B中含鋇離子、鈉離子和氫氧根離子,加入碳酸鈉生成碳酸鋇沉淀,
(1)加鐵屑后發生的離子反應有鐵離子、銅離子和氫離子與鐵反應,所以加鐵屑后發生的離子反應有3條,故選:c;
(2)沉淀a中含有的單質是鐵和銅,故答案為:鐵和銅;
(3)沉淀c的化學式是碳酸鋇,所以化學式為:BaCO3,故答案為:BaCO3;
(4)H2O2與Fe2+在酸性條件下反應生成鐵離子、水,反應的離子方程式為:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案為:H2O2+2Fe2++2H+=2Fe3++2H2O.
點評 本題考查了鐵銅及其化合物的知識,主要利用題給信息,結合流程圖和實驗目的正確解答.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 其含有的共價鍵類型是極性共價鍵.
其含有的共價鍵類型是極性共價鍵.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na和AlCl3溶液反應 | B. | 最高價氧化物對應水化物的堿性 | ||
| C. | 單質與H2O反應的難易程度 | D. | 同濃度NaCl和AlCl3溶液的pH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將溶液稀釋到原體積的10倍 | B. | 加入適量的醋酸鈉固體 | ||
| C. | 加入等體積0.1 mol/L燒堿溶液 | D. | 加入等體積0.1 mol/L鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10 mL0.1 mol•L-1氨水與10 mL0.1 mol•L-1鹽酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液與5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液與5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液與6 mL 1 mol•L-1鹽酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com