
 其含有的共價鍵類型是極性共價鍵.
其含有的共價鍵類型是極性共價鍵.
分析 (1)①根據羰基硫分子結構和CO2相似,羰基硫分子中所有原子的最外層都滿足8電子結構判斷其電子式;
②利用氫化物穩定性、最高價氧化物水化物酸性及得電子能力比較非金屬性;
(2)由反應物、生成物及電子守恒書寫化學反應;
(3)①pH=13時,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根據硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②當Qc=Ksp(MnS)時開始沉淀,由此求出硫離子的濃度,結合圖象得出此時的pH;
(4)由圖可知,右側H得到電子生成氫氣,則右側為陰極,陽極上Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應,同時S元素得電子生成H2S.
解答 解:(1)①羰基硫中分子中所有原子的最外層都滿足8電子結構,碳原子能形成4個共價鍵,硫原子能形成2個共價鍵,氧原子能形成2個共價鍵,所以其電子式為 ,只含極性共價鍵,
,只含極性共價鍵,
故答案為: ;極性;
;極性;
②a.相同條件下水溶液的pH:NaHCO3>NaHSO4,可知硫酸酸性大于碳酸,則非金屬性S>C,故選;
b.亞硫酸不是最高價含氧酸,則酸性:H2SO3>H2CO3,不能比較非金屬性,故不選;
c.S與H2的化合比C與H2的化合更容易,則非金屬性S>C,故選;
故答案為:ac;
(2)H2S具有還原性,在酸性條件下,能與KMnO4反應生成S、MnSO4、K2SO4和H2O,該反應的化學方程式為5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案為:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
(3)①根據溶液pH與c(S2-)關系圖pH=13時,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根據硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案為:0.043;
②當Qc=Ksp(MnS)時開始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,結合圖象得出此時的pH=5,所以pH=5時錳離子開始沉淀,
故答案為:5;
(4)①陽極上硫離子放電,電極反應式為S2--2e-═S,陰極上氫離子放電生成氫氣,電極反應式為2H++2e-=H2↑,故答案為:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②電解后陽極區離子為Sn2-,酸性條件下,Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應生成S單質,同時S元素得電子生成H2S,反應方程式為Sn2-+2H+=(n-1)S↓+H2S↑,故答案為:Sn2-+2H+=(n-1)S↓+H2S↑.
點評 本題考查較綜合,涉及化學鍵、非金屬性比較、氧化還原反應、離子濃度大小比較急電化學等,綜合性較強,注重化學反應原理的考查,把握相關反應原理為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 13C與15N具有相同的中子數 | |
| B. | 0.012kg 13C所含的碳原子數為阿伏加德羅常數 | |
| C. | 等物質的量的13C17O和15N2,兩氣體具有相同的質子數、原子數和質量 | |
| D. | 13C、15N和C60、N70互為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)2CHCH3 | C. | (CH3)2CH-CH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
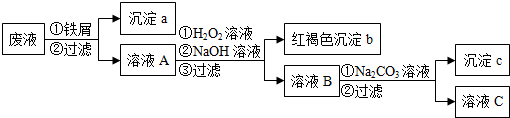
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| Y | ||
| X | ||
| Z |
| A. | Y是非金屬性最強的元素 | B. | Z是金屬元素 | ||
| C. | Y的原子序數為a-7 | D. | X的氣態氫化物化學式為H2X |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 不同時間各物質的物質的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稱取10.6 g無水碳酸鈉,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反復倒轉、搖勻 | |
| C. | 轉移Na2CO3溶液時,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 稱取10.6 g無水碳酸鈉,加入100 mL蒸餾水,攪拌、溶解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com