
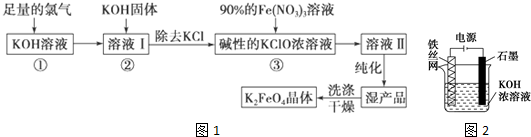
分析 足量Cl2通入和KOH溶液中,溫度低時發(fā)生反應Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯氣完全反應,且將溶液轉(zhuǎn)化為堿性溶液,只有堿性條件下次氯酸根離子才能和鐵離子發(fā)生氧化還原反應生成高鐵酸根離子,除去KCl得到堿性的KClO濃溶液,向堿性的KClO濃溶液中加入90%的Fe(NO3)3溶液,發(fā)生反應2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,純化得到濕產(chǎn)品,將濕產(chǎn)品洗滌、干燥得到晶體K2FeO4,
(1)KOH溶液和足量Cl2發(fā)生反應生成KCl、KClO和H2O;
(2)KOH和氯氣反應生成KClO,除去未反應的氯氣,且只有堿性條件下,鐵離子才能和次氯酸根離子發(fā)生氧化還原反應生成高鐵酸根離子;
(3)反應③中鐵離子和次氯酸根粒子發(fā)生氧化還原反應生成高鐵酸根離子;根據(jù)轉(zhuǎn)移電子相等計算氧化劑的物質(zhì)的量;
(4)該反應中Fe元素化合價由+6價變?yōu)?3價、O元素化合價由-2價變?yōu)?價,根據(jù)轉(zhuǎn)移電子相等配平方程式;
(5)Na2FeO4能消毒、凈水的原因高價鐵具有氧化性,能消毒殺菌,生成Fe3+形成膠體,具有吸附懸浮物的凈水的作用,電解時陽極Fe失電子發(fā)生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
(6)負極上鋅失電子發(fā)生氧化反應,據(jù)此書寫即可.
解答 解:足量Cl2通入和KOH溶液中,溫度低時發(fā)生反應Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯氣完全反應,且將溶液轉(zhuǎn)化為堿性溶液,只有堿性條件下次氯酸根離子才能和鐵離子發(fā)生氧化還原反應生成高鐵酸根離子,除去KCl得到堿性的KClO濃溶液,向堿性的KClO濃溶液中加入90%的Fe(NO3)3溶液,發(fā)生反應2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,純化得到濕產(chǎn)品,將濕產(chǎn)品洗滌、干燥得到晶體K2FeO4,
(1)KOH溶液和足量Cl2發(fā)生反應生成KCl、KClO和H2O,離子方程式為Cl2+2OH-=Cl-+ClO-+H2O,故答案為:Cl2+2OH-=Cl-+ClO-+H2O;
(2)KOH和氯氣反應生成KClO,除去未反應的氯氣,且只有堿性條件下,鐵離子才能和次氯酸根離子發(fā)生氧化還原反應生成高鐵酸根離子,所以加入KOH的目的是除去氯氣且使溶液為堿性,故選AC;
(3)反應③中鐵離子和次氯酸根粒子發(fā)生氧化還原反應生成高鐵酸根離子,離子方程式為2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
n(K2FeO4)=$\frac{59.4g}{198g/mol}$=0.3mol,根據(jù)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O知,氧化劑的物質(zhì)的量=$\frac{0.3mol}{2}$×3=0.45mol,
故答案為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;0.45;
(4)該反應中Fe元素化合價由+6價變?yōu)?3價、O元素化合價由-2價變?yōu)?價,其轉(zhuǎn)移電子數(shù)為6,根據(jù)轉(zhuǎn)移電子相等、電荷守恒配平方程式為4FeO42-+10H2O=2Fe(OH)3(膠體)+3O2↑+8OH-,
故答案為:4;10;4;3;8;
(5)Na2FeO4能消毒、凈水的原因高價鐵具有氧化性,能消毒殺菌,生成Fe3+形成膠體,具有吸附懸浮物的凈水的作用,電解時陽極Fe失電子發(fā)生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
故答案為:Fe+8OH--6e-═FeO42-+4H2O;
(6)該原電池放電時,負極上鋅失電子和氫氧根離子反應生成氫氧化鋅,電極反應式為:Zn+2OH--2e-=Zn(OH)2,充電時,氫氧根離子參加反應生成水,所以隨著反應的進行,氫氧根離子濃度減小,溶液的pH減小,故答案為:Zn+2OH--2e-=Zn(OH)2.
點評 本題考查物質(zhì)的分離和提純,側(cè)重考查學生分析、計算能力和思維的縝密性,涉及氧化還原反應方程式的配平、離子方程式的書寫,會從整體上分析物質(zhì)分離流程,知道每一步發(fā)生的反應及基本操作,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-異丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
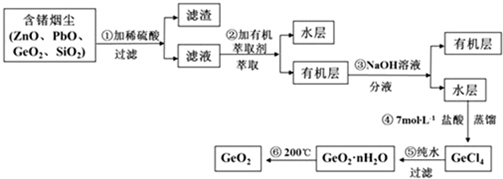
 (3)第④步加入鹽酸作用中和NaOH,作反應物,抑制GeCl4水解(答兩點即可).
(3)第④步加入鹽酸作用中和NaOH,作反應物,抑制GeCl4水解(答兩點即可).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;②NaOH
;②NaOH .
.| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2分子比例模型: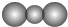 | |
| B. | 中子數(shù)為21的鉀原子:4019K | |
| C. | NH4I的電子式: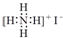 | |
| D. | HCO3-的電離方程式:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

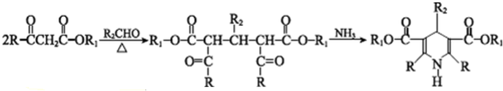
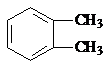 $→_{光}^{氯氣}$
$→_{光}^{氯氣}$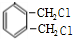 $→_{△}^{氫氧化鈉溶液}$
$→_{△}^{氫氧化鈉溶液}$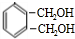 $→_{催化劑}^{氧氣}$
$→_{催化劑}^{氧氣}$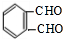 .
.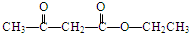 .
.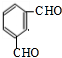 .
.查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com