
分析 (1)銅是29號元素,位于周期表中第四周期,第ⅠB族,根據原子核外電子排布規律可寫出Cu2+的核外電子排布式,據此答題;
(2)加熱條件下,銅和濃硫酸反應生成硫酸銅、二氧化硫和水,無水硫酸銅是白色的,CuSO4•5H2O是藍色的,顯示水合銅離子特征藍色;
(3)根據SO42-中心原子含有的共價鍵個數與孤電子對個數之和確定其空間構型和雜化方式;
(4)氧離子的半徑小于硫離子,根據離子半徑對晶格能的影響可知,半徑越小,晶格能越大,物質的熔沸點就越高;
(5)N、F、H三種元素的電負性:F>N>H,所以NH3中共用電子對偏向N,而在NF3中,共用電子對偏向F,偏離N原子;
(6)元素金(Au)處于周期表中的第六周期,與Cu同族,則最外層電子數為1,以此判斷電子排布式,利用均攤法計算晶胞;
(7)CaF2的結構如圖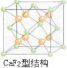 ,利用均攤法計算.
,利用均攤法計算.
解答 解:(1)銅是29號元素,位于周期表中第四周期,第ⅠB族,根據原子核外電子排布規律可寫出Cu2+的核外電子排布式為1s22s22p63s23p63d9,
故答案為:ⅠB;1s22s22p63s23p63d9;
(2)加熱條件下,銅和濃硫酸反應生成硫酸銅、二氧化硫和水,反應方程式為:Cu+2 H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,白色無水硫酸銅可與水結合生成藍色的CuSO4•5H2O,顯示水合銅離子特征藍色;
故答案為:Cu+2 H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;白色無水硫酸銅可與水結合生成藍色的CuSO4•5H2O;
(3)SO42-離子中含有4個σ鍵,沒有孤電子對,所以其立體構型是正四面體,硫原子采取sp3雜化;
故答案為:正四面體;sp3;
(4)氧離子的半徑小于硫離子,半徑越小,晶格能越大,物質的熔沸點就越高,所以Cu2O的熔點比Cu2S的高;
故答案為:高;半徑越小,晶格能越大,物質的熔沸點就越高;
(5)N、F、H三種元素的電負性:F>N>H,所以NH3中共用電子對偏向N,而在NF3中,共用電子對偏向F,偏離N原子,導致NF3中N原子核對其孤對電子的吸引能力增強,難以形成配位鍵,故NF3不易與Cu2+形成配離子;
故答案為:F的電負性大于N,NF3中,共用電子對偏向F,偏離N原子,導致NF3中N原子核對其孤對電子的吸引能力增強,難以形成配位鍵;
(6)元素金(Au)處于周期表中的第六周期,與Cu同族,則最外層電子數為1,則最外層電子排布式為6s1,在晶胞中Cu原子處于面心,N(Cu)=6×$\frac{1}{2}$=3,Au原子處于頂點位置,N(Au)=8×$\frac{1}{8}$=1,則該合金中Cu原子與Au原子數量之比為3:1,為金屬晶體,原子間的作用力為金屬鍵;
故答案為:6s1;3:1;金屬鍵;
(7)CaF2的結構如圖 ,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中,則H原子應位于晶胞內部,則應含有8個H,則化學式為Cu3AuH8;
,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中,則H原子應位于晶胞內部,則應含有8個H,則化學式為Cu3AuH8;
故答案為:Cu3AuH8.
點評 本題考查物質結構和性質,涉及晶胞計算、原子核外電子排布、原子雜化、空間構型判斷、氧化還原反應等知識點,側重考查學生分析計算能力,解題的難點在第(7)中對常見晶胞要熟記.


科目:高中化學 來源: 題型:解答題
 (或寫成
(或寫成 R代表取代基或氫)
R代表取代基或氫)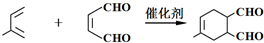 .
.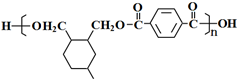 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,1mol水的體積約是22.4升 | |
| B. | 1molH2所占的體積約是22.4升 | |
| C. | 標準狀況下,6.02×1023個分子所占的體積約是22.4升 | |
| D. | 標準狀況下,28g氮氣和CO的混合氣體的體積約是22.4升 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 產品標準 | GB5461 |
| 產品等級 | 一級 |
| 配 料 | 食鹽、碘酸鉀、抗結劑 |
| 碘含量(以I計) | 20~50mg/kg |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
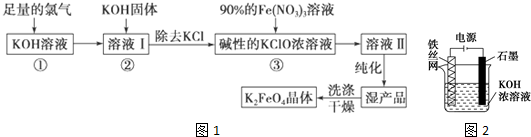
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬性:Na>Mg | B. | 熱穩定性:HF>HCl | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 氧化性:O2>S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
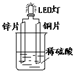
| A. | 鋅片換成鐵片,電路中的電流方向不變 | |
| B. | 銅電極的電極反應式為Cu2++2e-=Cu | |
| C. | 將硫酸換成檸檬汁,導線中仍有電子流動 | |
| D. | 裝置中存在“化學能→電能→光能”的轉換 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com