
 .
. .
.分析 (1)根據n=$\frac{m}{M}$結合分子的組成分析解答;
(2)依據摩爾質量的概念分析計算,摩爾質量數值上等于其相對分子質量,依據化學式計算A的相對原子質量,判斷元素種類,再畫出A2+的結構示意圖;
(3)相同條件下,體積之比等于物質的量之比等于分子數之比,據此判斷反應方程式各物質的化學計量數,根據方程式原子守恒計算C的化學式;
(4)①在該反應中錳從+7價降為+2價,氯從-1價升為0價,根據化合價升降法結合原子守恒可配平;
②反應生成被氧化的HCl全轉化為氯氣,根據氯氣的體積計算.
解答 解:(1)相同物質的量的CO2和O2,其含有的O的物質的量為3:2,則其原子數之比為3:2,則電子數之比為22:16=11:8;質量相同的CO2和O2,其物質的量之比為 $\frac{m}{44}:\frac{m}{32}$=8:11;
故答案為:3:2;11:8;
(2)19g某二價金屬的氯化物ACl2中含有0.4mol Cl-,則ACl2的物質的量為0.2mol,摩爾質量=$\frac{19g}{0.2mol}$=95g/mol;ACl2中A的相對原子質量=95-35.5×2=24;依據相對原子質量為24,為鎂,則Mg2+的結構示意圖為 ;
;
故答案為:95g/mol; ;
;
(3)由于5體積氣體A2跟15體積的氣體B2完全化合生成10體積某氣體C,所以A2、B2、C的化學計量數之比為1:3:2,所以方程式為A2+3B2=2C,根據原子守恒可知C的化學式為AB3或B3A,
故答案為:AB3或B3A;
(4)①在該反應中錳從+7價降為+2價,氯從-1價升為0價,在氧化還原反應元素化合價升高的總數與降低的總數應相等,結合質量守恒可知,該反應的方程式為2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O,該反應轉移10e-,雙線橋標出電子的轉移方向和數目為 ,
,
故答案為: ;
;
②若有4.48L氯氣(標準狀況)生成,則n(Cl2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,反應生成被氧化的HCl全轉化為氯氣,由Cl守恒可知,被氧化的HCl為0.4mol;
故答案為:0.4mol.
點評 本題考查了物質的量的計算、氧化還原反應,把握物質的量的計算公式、反應中元素的化合價變化為解答的關鍵,側重分析能力和計算能力的考查,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:實驗題
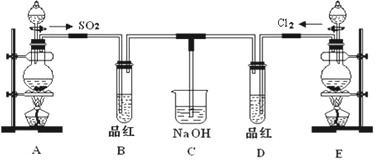
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有⑤ | B. | 均能 | C. | ③④⑤ | D. | 均不能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制作印刷電路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 硫酸鎂溶液與氫氧化鋇溶液反應:SO42-+Ba2+═BaSO4↓ | |
| D. | KClO3溶液與濃鹽酸反應:ClO3-+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-、Br-、I- | B. | Br-、I-、Cl- | C. | Br-、Cl-、I- | D. | Cl-、I-、Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 CH3COONa溶液與0.1 mol•L-1 HCl溶液等體積混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液與0.1 mol•L-1氨水等體積混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液與0.1 mol•L-1 NaHCO3溶液等體積混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液與0.1 mol•L-1 HCl溶液等體積混合(H2C2O4為二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
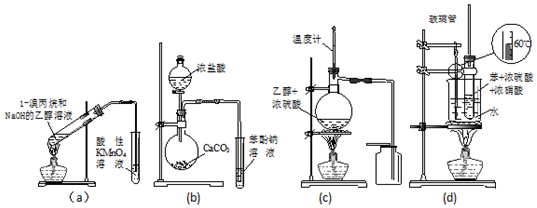
| A. | a裝置直接用酸性KMnO4溶液檢驗消去反應的產物 | |
| B. | b裝置檢驗酸性:鹽酸>碳酸>苯酚 | |
| C. | c裝置用于實驗室制取并收集乙烯 | |
| D. | d裝置用于實驗室制硝基苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
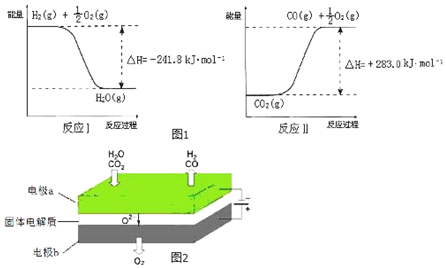
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
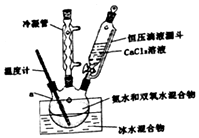 過氧化鈣(CaO2)是一種白色結晶體粉末,極微溶于水,不溶于醇類、乙醚等,加熱至150℃左右開始分解放出氧氣,與水緩慢反應生成H2O2.易于酸反應生成H2O2
過氧化鈣(CaO2)是一種白色結晶體粉末,極微溶于水,不溶于醇類、乙醚等,加熱至150℃左右開始分解放出氧氣,與水緩慢反應生成H2O2.易于酸反應生成H2O2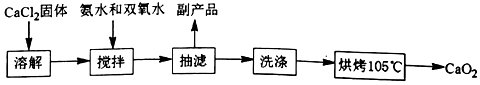
| 數據 時間 | 樣品取用質量/(g) | 平均消耗體積(KMnO4)/mL |
| 放置前測定 | a | 25.00 |
| 放置一個月后測定 | a | 24.00 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com