
分析 由Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知,14.51g為碳酸鋇、硫酸鋇的混合物,加稀硝酸,碳酸鋇溶解,最后4.66g為硫酸鋇,以此來解答.
解答 解:(1)由BaCO3~Na2CO3~CO2可知,產生的氣體在標準狀況下的體積為$\frac{14.51g-4.66g}{197g/mol}$×22.4L/mol=1.12L,
答:產生的氣體在標準狀況下的體積1.12L;
(2)n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,n(BaCO3)=0.05mol,結合Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知生成NaOH為0.02mol×2+0.05mol×2=0.14mol,則NaOH溶液的濃度為$\frac{0.14mol}{0.2L}$=0.7mol/L,
答:所得濾液的物質的量濃度為0.7mol/L.
點評 本題考查化學反應的計算,為高頻考點,把握物質的性質、發生的反應、物質的量關系等為解答的關鍵,側重分析與計算能力的考查,注意原子守恒的應用,題目難度不大.


 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:實驗題
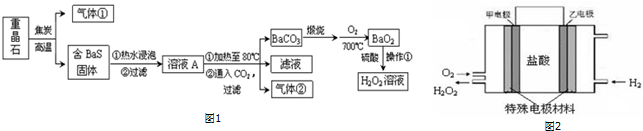
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗及試劑 | 編號 | 無色NaClO3 溶液用量 | 試管中 溶液顏色 | 淀粉KI 試紙顏色 |
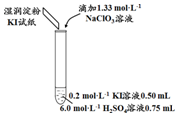 | 1 | 0.05 mL | 淺黃色 | 無色 |
| 2 | 0.20 mL | 深黃色 | 無色 | |
| 3 | 0.25 mL | 淺黃色 | 藍色 | |
| 4 | 0.30 mL | 無色 | 藍色 |
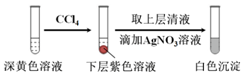
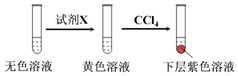
| 編號 | 6.0 mol•L-1 H2SO4溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
| 5 | 0.25 mL | 淺黃色 | 無色 |
| 6 | 0.85 mL | 無色 | 藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L的CCl4中C-Cl鍵數為為4NA | |
| B. | 常溫下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子數為0.2 NA | |
| C. | 在反應KIO3+6HI=KI+3I2+3H2O中,每生成3molI2轉移的電子數為6 NA | |
| D. | 0.1mol乙酸與0.1mol乙醇反應生成乙酸乙酯的分子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
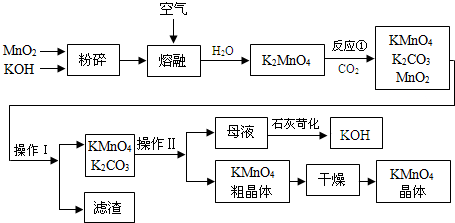

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com