
| 實驗及試劑 | 編號 | 無色NaClO3 溶液用量 | 試管中 溶液顏色 | 淀粉KI 試紙顏色 |
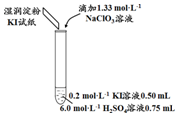 | 1 | 0.05 mL | 淺黃色 | 無色 |
| 2 | 0.20 mL | 深黃色 | 無色 | |
| 3 | 0.25 mL | 淺黃色 | 藍色 | |
| 4 | 0.30 mL | 無色 | 藍色 |
| 編號 | 6.0 mol•L-1 H2SO4溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
| 5 | 0.25 mL | 淺黃色 | 無色 |
| 6 | 0.85 mL | 無色 | 藍色 |
分析 (1)加入0.20mL NaClO3后,溶液顏色變為深黃色,淀粉KI試紙顏色變藍色,說明氯酸根離子具有氧化性能氧化碘離子為單質碘;
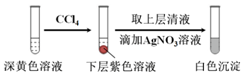
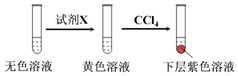
(2)①加入0.30 mLNaClO3后,溶液為無色,NaClO3溶液用量增加導致溶液褪色的原因是過量的NaClO3溶液與(1)中的反應產物繼續反應,同時生成Cl2;取少量實驗4中的無色溶液進行如圖實驗,進一步佐證其中含有IO3-,
②將實驗4中的濕潤淀粉KI試紙替換為濕潤的淀粉試紙,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,發現濕潤的淀粉試紙沒有明顯變化,說明無碘單質生成,NaClO3溶液用量增加導致溶液褪色的原因是過量的NaClO3溶液與(1)中的反應產物繼續反應,同時生成Cl2;說明是氯氣的氧化性以后碘離子生成了碘單質;NaClO3溶液用量增加導致溶液褪色的原因是氯酸根離子以后碘單質為碘酸根離子;
(3)①對比實驗5和6,硫酸用量不同試管中溶液顏色不同說明氫離子濃度不同氯酸根離子以后碘離子產物不同;
②實驗6的現象是氯酸根離子以后碘離子生成碘酸根,通式生成氯氣能使濕潤的淀粉KI試紙變藍色.
解答 解:(1)加入0.20mL NaClO3后,溶液顏色變為深黃色,淀粉KI試紙顏色變藍色,說明氯酸根離子具有氧化性能氧化碘離子為單質碘,反應的離子方程式為:ClO3-+6I-+6H+═Cl-+3I2+3H2O,
故答案為:ClO3-+6I-+6H+═Cl-+3I2+3H2O;
(2)①取少量實驗4中的無色溶液進行如圖實驗,無色溶液中加入試劑X變為黃色,加入四氯化碳萃取得到下層紫紅色,說明生成了碘單質,加入的試劑具有還原性,能和碘酸根離子發生氧化還原反應生成碘單質,選擇c選項的NaHSO3溶液,a選項含碘單質不能驗證,b為高錳酸鉀溶液具有氧化性,不符合要求,進一步佐證其中含有IO3-,所選試劑為c,
故答案為:c;
②將實驗4中的濕潤淀粉KI試紙替換為濕潤的淀粉試紙,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,發現濕潤的淀粉試紙沒有明顯變化,說明無碘單質生成,排除易升華的I2對濕潤淀粉KI試紙檢驗Cl2的干擾,NaClO3溶液用量增加導致溶液褪色的原因是過量的NaClO3溶液與(1)中的反應產物繼續反應,同時生成Cl2;說明是氯氣的氧化性以后碘離子生成了碘單質;NaClO3溶液用量增加導致溶液褪色的原因是氯酸根離子以后碘單質為碘酸根離子,反應的離子方程式為:2ClO3-+I2═Cl2↑+2IO3-,
故答案為:排除易升華的I2對濕潤淀粉KI試紙檢驗Cl2的干擾;2ClO3-+I2═Cl2↑+2IO3-;
(3)①對比實驗5和6,硫酸用量不同試管中溶液顏色不同說明氫離子濃度不同氯酸根離子以后碘離子產物不同,獲得的結論是ClO3-和I-的反應規律與H+(或H2SO4)的用量有關,
故答案為:ClO3-和I-的反應規律與H+(或H2SO4)的用量有關;
②實驗6的現象是氯酸根離子以后碘離子生成碘酸根,通式生成氯氣能使濕潤的淀粉KI試紙變藍色,反應的離子方程式為:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O,
故答案為:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
點評 本題考查了物質性質的實驗驗證、物質反應的現象、物質用量不同反應產物不同發生反應的現象不同,注意反應用量的分析判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
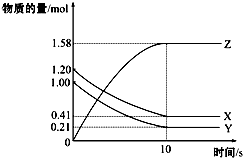 一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示:下列描述正確的是( )
一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示:下列描述正確的是( )| A. | 反應開始到10s,用Z表示的反應速率為0.158 mol/(L•s) | |
| B. | 反應開始到10s,X的物質的量濃度減少了0.79 mol/L | |
| C. | 反應開始到10s時,Y的轉化率為79.0% | |
| D. | 在前10s內用X、Y、Z表示的反應速率數值相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入適量的鹽酸 | |
| C. | 向某無色未知溶液中僅加入BaCl2溶液,以檢驗未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可將鹽酸、硫酸、硫酸鈉、氫氧化鈉和硝酸鉀五種無色溶液鑒別開 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵粉作袋裝食品的抗氧化劑 | B. | 二氧化硫作紙漿的漂白劑 | ||
| C. | 氫氟酸作普通玻璃的刻蝕劑 | D. | 有機溶劑作食用油的萃取劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
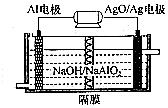 (1)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料.FeCl3和KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;與MnO2-Zn電池類似,K2FeO4-Zn也可以組成堿性電池,K2FeO4在電池中作為正極材料,其電極反應為FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,該電池總反應的離子方程式為3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(1)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料.FeCl3和KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;與MnO2-Zn電池類似,K2FeO4-Zn也可以組成堿性電池,K2FeO4在電池中作為正極材料,其電極反應為FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,該電池總反應的離子方程式為3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當b>2a時,發生的離子反應為:CO32-+2H+=H2O+CO2↑ | |
| B. | 當b<a時,發生的離子反應為:CO32-+H+=HCO3- | |
| C. | 當4a=3b時,發生的離子反應為:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 當a<b<2a時,反應生成的HCO3-與CO2的物質的量之比為(b-a):(2b-a) |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com