
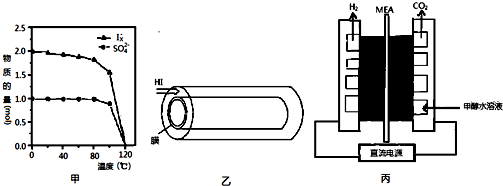
分析 (1)根根據蓋斯定律計算氫氣與氧氣反應生成液態水的反應熱,并書熱化學寫方程式;
(2)①1mol SO2和3mol I2發生氧化還原反應生成SO42-和Ix-,依據反應中電子守恒可求出x;
②溫度達到120℃時,碘單質、水、二氧化硫均為氣態;
(3)反應Ⅲ是在圖乙中進行,其中的高分子膜只允許產物通過,相當于移走產物;根據平衡移動原理還可采取其它措施;
(4)①根據圖3可知陽極應為甲醇失電子得到CO2;
②合金吸氫后得到僅含一種金屬的氫化物,其中氫的質量分數為0.077和一種金屬單質,據此推出MgH2和Al,由此寫出反應方程式.
解答 解:(1)已知:Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g)△H=35.9kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l)△H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g)△H=14.9kJ/mol
則氫氣和氧氣反應生成液態水2H2(g)+O2(g)=H2O(l)的反應可以是-I×2-Ⅱ-Ⅲ×2得到,所以此時△H=-(35.9kJ/mol×2+470kJ/mol+14.9kJ/mol×2=-571.6kJ/mol,
故答案為:-571.6;
(2)①向水中加入1mol SO2和3mol I2,在不同溫度下恰好完全反應生成的n(SO42-)和n(Ix-),依據反應中硫元素由+4價變為+6價,則x=3;
故答案為:3;
②溫度達到120℃時,碘單質、水、二氧化硫均為氣態,氣相中SO2的還原性弱,I2氧化性也弱,故它們在氣相中不發生反應,
故答案為:此溫度下碘單質、水、二氧化硫均為氣態,氣相中不發生反應;
(3)反應Ⅲ是在圖乙中進行,其中的高分子膜只允許產物通過,相當于移走產物,因此反應程度增大;根據平衡移動原理還可采取向裝置中通入氮氣(或其它“惰性”氣體)吹出產物;
故答案為:增大; 向裝置中通入氮氣(或其它“惰性”氣體)吹出產物;
(4)①根據圖3可知陽極應為甲醇失電子得到CO2,則陽極反應式為CH3OH+H2O-6e-=CO2↑+6H+;
故答案為:CH3OH+H2O-6e-=CO2↑+6H+;
②合金吸氫后得到僅含一種金屬的氫化物,其中氫的質量分數為0.077和一種金屬單質,據此推出MgH2和Al,由此寫出反應方程式為Mg17Al12+17H2=17MgH2+12Al;
故答案為:Mg17Al12+17H2=17MgH2+12Al.
點評 本題考查了熱化學方程式和蓋斯定律的計算應用,化學平衡常數的影響因素判斷,電離平衡,屬于拼合型題目,對學生的心理有較高的要求,掌握基礎是關鍵,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min SO2質量/10-3g 溫度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/min | 平衡時的熱量變化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一組 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二組 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K為已知反應的平衡常數,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同溫度下,在第二組平衡后的混合氣體中再加入2molHI,重新達到平衡后,HI的轉化率為21.6% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定溫度下,在三個容積均為2.0L的恒容密閉容器中發生反應:
一定溫度下,在三個容積均為2.0L的恒容密閉容器中發生反應:| 容器 | 溫度/℃ | 起始物質的量/mol | |
| NO(g) | CO(g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 該反應的正反應為吸熱反應 | |
| B. | 達到平衡時,乙中CO2的體積分數比甲中的小 | |
| C. | T1℃時,若起始時向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,則反應達到新平衡前v(正)<v(逆) | |
| D. | T2℃時,若起始時向丙中充入0.06molN2和0.12molCO2,則達平衡時N2的轉化率大于40% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向溶液中滴加Na2CO3溶液,立即產生沉淀和氣體 | |
| B. | 若C(Cl-)=0.07mol/L,則溶液的PH為2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈紅褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此時溶液中C(NH4+)═C(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com