
分析 (1)碳酸鈣和鹽酸反應生成氯化鈣和水、二氧化碳;
(2)氫氧化鋇溶液和稀硫酸反應生成硫酸鋇和水;
(3)NaHSO4在水中完全電離出鈉離子、氫離子和硫酸根離子;
(4)H++OH-═H2O可以表示強酸與強堿反應生成可溶性鹽和水的反應;
(5)CO32-+2H+═CO2↑+H2O可以表示可溶性碳酸鹽和強酸反應生成可溶性鹽和水、二氧化碳的反應.
解答 解:(1)碳酸鈣和鹽酸反應生成氯化鈣和水、二氧化碳,離子方程式:CaCO3+2H+=Ca2++CO2↑++H2O;
故答案為:CaCO3+2H+=Ca2++CO2↑++H2O;
(2)氫氧化鋇溶液和稀硫酸反應生成硫酸鋇和水,離子方程式:2H++2SO42-+Ba2++2OH-=2H2O+BaSO4↓;
故答案為:2H++2SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(3)NaHSO4在水中完全電離出鈉離子、氫離子和硫酸根離子,電離方程式:NaHSO4=Na++H++SO42-;
故答案為:NaHSO4=Na++H++SO42-;
(4)H++OH-═H2O可以表示強酸與強堿反應生成可溶性鹽和水的反應,可以表示鹽酸與氫氧化鈉的反應,化學方程式:NaOH+HCl=NaCl+H2O;
故答案為:NaOH+HCl=NaCl+H2O;
(5)CO32-+2H+═CO2↑+H2O可以表示可溶性碳酸鹽和強酸反應生成可溶性鹽和水、二氧化碳的反應,可以表示鹽酸與碳酸鈉的反應,方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
故答案為:Na2CO3+2HCl=2NaCl+CO2↑+H2O.
點評 本題考查了離子方程式的書寫,明確反應的實質及離子方程式書寫方法是解題關鍵,注意化學式的拆分,題目難度不大.


 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:選擇題
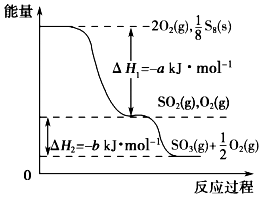 在一定條件下,S8(s)和O2(g)發生反應依次轉化為SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反應過程中的能量關系可用如圖簡單表示(圖中的△H 表示生成1mol產物的數據). 下列說法正確的是( )
在一定條件下,S8(s)和O2(g)發生反應依次轉化為SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反應過程中的能量關系可用如圖簡單表示(圖中的△H 表示生成1mol產物的數據). 下列說法正確的是( )| A. | S8的燃燒熱△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和過量 O2反應可釋放出 b kJ 的熱量 | |
| C. | 已知1個S8分子中有8個S-S,S=O的鍵能為d kJ•mol-1,O=O的鍵能為e kJ•mol-1,則S8分子中S-S的鍵能為(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化劑,當SO2(g)轉化生成1mol SO3(g)時,釋放的熱量小于b kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A的質量分數增加 | B. | 平衡不移動 | ||
| C. | 化學計量數:m+n=3 | D. | 物質C的體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵與稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳與稀鹽酸反應:H++OH-═H2O | |
| C. | 氫氧化鎂溶于鹽酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 銅片插入硝酸銀溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
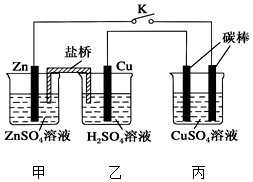 用如圖所示的裝置進行實驗,反應一段時間后斷開K,向丙燒杯中加入0.1mol CuO后,CuSO4溶液恰好恢復到反應前的濃度.下列說法中不正確的是( )
用如圖所示的裝置進行實驗,反應一段時間后斷開K,向丙燒杯中加入0.1mol CuO后,CuSO4溶液恰好恢復到反應前的濃度.下列說法中不正確的是( )| A. | 乙燒杯中銅棒為正極,其電極反應式為2H++2e-═H2↑ | |
| B. | 丙燒杯右側碳棒為陰極,其電極表面有紅色物質析出 | |
| C. | 反應時鹽橋中的陰離子向甲燒杯移動 | |
| D. | 導線中通過電子的物質的量為0.1 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com