
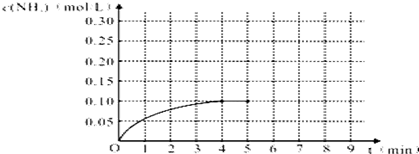
 一定溫度下,在三個容積均為2.0L的恒容密閉容器中發生反應:
一定溫度下,在三個容積均為2.0L的恒容密閉容器中發生反應:| 容器 | 溫度/℃ | 起始物質的量/mol | |
| NO(g) | CO(g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 該反應的正反應為吸熱反應 | |
| B. | 達到平衡時,乙中CO2的體積分數比甲中的小 | |
| C. | T1℃時,若起始時向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,則反應達到新平衡前v(正)<v(逆) | |
| D. | T2℃時,若起始時向丙中充入0.06molN2和0.12molCO2,則達平衡時N2的轉化率大于40% |
分析 A.先拐先平溫度高,甲平衡狀態二氧化碳物質的量小,說明溫度越高平衡逆向進行;
B.乙中可以看做是甲起始量達到平衡狀態,再加入0.1molNO和0.1molCO,相當于增大平衡壓強,平衡正向進行;
C.甲狀態下平衡時CO2物質的量為0.10mol,結合三行計算計算平衡常數,依據起始量計算濃度商和平衡常數比較判斷反應進行方向;
D.T2℃時,依據圖象可知平衡狀態下CO2物質的量為0.12mol,若起始時向丙中充入0.06mol N2和0.12 mol CO2,反應逆向進行得到平衡狀態,和起始量為0.12molNO和0.12molCO達到的平衡等效,和起始量0.2molCO、0.2molNO相比,相當于減少了NO、CO各0.08mol,相當于壓強減小平衡逆向進行.
解答 解:A.2NO(g)+2CO(g)?N2(g)+2CO2(g),先拐先平溫度高,甲狀態溫度高于丙,T1>T2,此時甲平衡狀態二氧化碳物質的量小,說明溫度越高平衡逆向進行,逆反應為吸熱反應,正反應為放熱反應,故A錯誤;
B.乙中可以看做是甲起始量達到平衡狀態,再加入0.1molNO和0.1molCO,相當于增大平衡壓強,平衡正向進行,達到平衡時,乙中CO2的體積分數比甲中的大,故B錯誤;
C.甲狀態下平衡時CO2物質的量為0.10mol,結合三行計算計算平衡常數,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol/L) 0.1 0.1 0 0
變化量(mol/L) 0.05 0.05 0.025 0.05
平衡量(mol/L) 0.05 0.05 0.025 0.05
K=$\frac{0.05{\;}^{2}×0.025}{0.05{\;}^{2}×0.05{\;}^{2}}$=10,
T1℃時,若起始時向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=$\frac{0.20{\;}^{2}×0.20}{0.20{\;}^{2}×0.20{\;}^{2}}$=5<K=10,則反應達到新平衡前v(正)>v(逆),故C錯誤;
D.T2℃時,平衡狀態CO2物質的量為0.12mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 0.2 0.2 0 0
變化量(mol) 0.12 0.12 0.06 0.12
平衡量(mol) 0.08 0.08 0.06 0.12
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 0 0 0.06 0.12
轉化量 0.12 0.12 0 0
則起始時向丙中充入0.06mol N2和0.12 mol CO2,反應逆向進行得到平衡狀態,和起始量為0.12molNO和0.12molCO達到的平衡等效,所以再和起始量0.2molCO、0.2molNO相比,相當于減少了NO、CO各0.08mol,壓強減小平衡逆向進行,所以氮氣轉化率大于40%,故D正確;
故選D.
點評 本題考查了化學平衡影響因素,數據分析判斷,主要是平衡常數的計算和圖線的理解應用,掌握基礎是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鐵與稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳與稀鹽酸反應:H++OH-═H2O | |
| C. | 氫氧化鎂溶于鹽酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 銅片插入硝酸銀溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
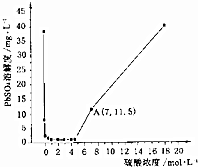 已知25℃時KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,該溫度下PbSO4在不同濃度的硫酸中的溶解度如圖所示.下列有關說法不正確的是( )
已知25℃時KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,該溫度下PbSO4在不同濃度的硫酸中的溶解度如圖所示.下列有關說法不正確的是( )| A. | 圖中A點c(SO42-)=7mol•L-1 | |
| B. | 過濾的PbSO4沉淀,用稀硫酸洗滌,可以減少沉淀損耗 | |
| C. | 硫酸濃度大于5mol•L-1時,PbSO4溶解度增大的原因是轉化成Pb(HSO4)2 | |
| D. | 將Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4兩種沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 苯乙烯(
苯乙烯(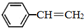 )是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
)是生產各種塑料的重要單體,可通過乙苯催化脫氫制得: CH2CH3(g)$\stackrel{催化劑}{?}$
CH2CH3(g)$\stackrel{催化劑}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.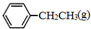 、
、 、H2(g)的燃燒熱(△H)分別為-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,寫出Q與Q1、Q2、Q3的關系式Q2+Q3-Q1.
、H2(g)的燃燒熱(△H)分別為-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,寫出Q與Q1、Q2、Q3的關系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
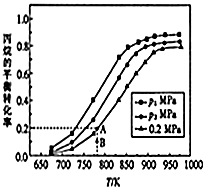 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工產品的原料.目前正在開發丙烷(C3H8)裂解制取丙烯,其原理為C3H8(g)?C3H6(g)+H2(g)△H.回答下列問題:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工產品的原料.目前正在開發丙烷(C3H8)裂解制取丙烯,其原理為C3H8(g)?C3H6(g)+H2(g)△H.回答下列問題:| 共價鍵 | C-C | C=C | C-H | H-H |
| 鍵能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)溫度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用惰性電極電解1L1mol•L-1的CuSO4溶液,當陰極析出3.2g銅時,加入0.05molCu(OH)2固體可將溶液恢復至原濃度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常溫下不能自發進行,說明△H>0 | |
| C. | 已知25℃時,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃時,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固體,該溶液中水的電離程度將增大,且Kw不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,5.6 L四氯化碳含有的分子數為0.25NA | |
| B. | 標準狀況下,14 g氮氣與11.2LNH3含有的原子數相同 | |
| C. | 標準狀況下,22.4 L任意比的氫氣和氯氣的混合氣體中含有的分子總數均為NA | |
| D. | 物質的量濃度為0.5mol/L MgCl2溶液,含有Cl-離子數為1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com