
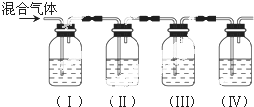
分析 (1)根據實驗的目的是檢驗乙烯和二氧化硫,所以需要先檢驗乙烯中含有二氧化硫,然后除去雜質二氧化硫,再檢驗乙烯;
(2)根據二氧化硫能漂白品紅進行檢驗;根據氫氧化鈉溶液能與二氧化硫反應的性質分析;檢驗乙烯前,必須先確認乙烯中的SO2已除干凈;Ⅲ中無二氧化硫,Ⅳ中與溴水反應的是乙烯;
(3)Ⅳ中乙烯與溴發生加成反應生成1,2-二溴乙烷,據此寫出反應方程式.
解答 解:(1)檢驗二氧化硫用品紅溶液,檢驗乙烯用溴水,乙烯和二氧化硫都能使溴水褪色,所以先檢驗二氧化硫,然后檢驗乙烯,同在檢驗乙烯之前用NaOH溶液除盡SO2,再通過品紅溶液不褪色確認SO2已除干凈,最后用溴水檢驗乙烯,
因裝置I用來檢驗SO2,試管中品紅溶液褪色,說明含有SO2,裝置II試管裝有NaOH溶液除去SO2,裝置III試管通過品紅溶液不褪色確認SO2已除干凈,裝置IV通過溴水褪色檢驗乙烯,
故答案為:A;B;A;D;
(2)裝置I用來檢驗是否存在SO2,試管中品紅溶液褪色,說明含有SO2;
氫氧化鈉溶液能夠與二氧化硫反應,所以裝置Ⅱ試管裝有NaOH溶液除去SO2;
通過裝置Ⅲ試管中通過品紅溶液不褪色,確認SO2已除干凈;
裝置Ⅳ通過溴水褪色檢驗乙烯,
故答案為:Ⅰ中品紅溶液褪色;除去二氧化硫以免干擾乙烯的檢驗;檢驗二氧化硫是否被完全除去;Ⅲ中的品紅不褪色,Ⅳ中的高錳酸鉀溶液褪色;
(3)裝置Ⅳ中是用溴水來檢驗乙烯,反應的方程式為:CH2=CH2+Br2→CH2Br-CH2Br,反應生成了1,2-二溴乙烷,
故答案為:CH2=CH2+Br2→CH2Br-CH2Br;1,2-二溴乙烷.
點評 本題考查了乙烯的實驗室制法以及產物的檢驗,題目難度中等,注意當有多種產物需檢驗時,應考慮先后順序;溴水既能氧化二氧化硫,又能與乙烯發生加成反應,檢驗乙烯前必須除去二氧化硫.


科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下達到化學平衡時,N2、H2和NH3的物質的量濃度之比為1:3:2 | |
| B. | 達到化學平衡時,N2完全轉化為NH3 | |
| C. | 達到化學平衡時,正反應和逆反應速率相等,且都為零 | |
| D. | 單位時間內消耗amolN2同時消耗2amolNH3,說明該反應已達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向碳酸鈉溶液中加入足量的鹽酸 CO32-+2H+═CO2↑+H2O | |
| B. | 單質鐵和三氯化鐵溶液反應生成氯化亞鐵 Fe+Fe3+═2Fe2+ | |
| C. | 金屬鈉與水反應生成氫氧化鈉和氫氣Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化銨晶體和石灰粉共熱產生氨氣 NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最終產物是葡萄糖 | |
| C. | 葡萄糖能發生氧化反應和水解反應 | |
| D. | 硬脂酸甘油脂的相對分子質量為890,故其屬于高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬加入水中主要目的是懸浮雜質沉降 | |
| B. | 塑料、光導纖維、合成橡膠都屬于有機高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可減少燃煤對大氣的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于減少白色污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器編號 | 起始時各物質物質的量/mol | 達到平衡的時間/min | 達平衡時體系能量的變化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出熱量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出熱量:Q | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com