
 氨在國民經濟中占有很重要的地位.現在約有80%的氨用來制造化肥,其余的用作生產其他化工產品的原料.氨氧化法制硝酸是工業上制硝酸的主要方法.
氨在國民經濟中占有很重要的地位.現在約有80%的氨用來制造化肥,其余的用作生產其他化工產品的原料.氨氧化法制硝酸是工業上制硝酸的主要方法.分析 (1)根據勒沙特列原理,增加壓強平衡向氣體體積減小的方向移動,而催化劑能同等程度的改變正逆反應速率,對化學平衡沒有影響;
(2)工業上考慮反應物的轉化率、反應速率、對設備的要求等因素,選擇合成氨的條件;
(3)①電解水制取氫氣,要消耗電能,反應難度較大;
②由煤或焦炭與水反應制取氫氣,反應殘留固體多,煤中雜質較多,得到氣體不純;
③由天然氣或重油制取氫氣,產生的污染較小,產生氫氣的效率較高;
(4)合成氨反應是可逆反應,未反應的氮氣和氫氣可以循環使用;
(5)根據元素守恒,純堿與NO和NO2反應,生成NaNO2、NaNO3,且放出CO2,據此寫反應的化學方程式.
解答 解:(1)根據勒沙特列原理,增加壓強平衡向氣體體積減小的方向移動,而催化劑能同等程度的改變正逆反應速率,對化學平衡沒有影響,
故答案為:壓強;
(2)工業上考慮反應物的轉化率、反應速率、對設備的要求等因素,選擇合成氨的條件為10~30MPa、400~500℃、鐵觸媒,
故答案為:鐵觸媒;10~30MPa;400~500℃;
(3)①電解水制取氫氣,要消耗電能,反應難度較大;
②由煤或焦炭與水反應制取氫氣,反應殘留固體多,煤中雜質較多,得到氣體不純;
③由天然氣或重油制取氫氣,產生的污染較小,產生氫氣的效率較高,反應方程式為CH4+H2O$\frac{\underline{催化劑}}{△}$CO+3H2、CO+H2O$\frac{\underline{催化劑}}{△}$CO2+H2,
故答案為:③;CH4+H2O$\frac{\underline{催化劑}}{△}$CO+3H2、CO+H2O$\frac{\underline{催化劑}}{△}$CO2+H2;
(4)合成氨反應是可逆反應,未反應的氮氣和氫氣可以循環使用,故答案為:N2、H2;
(5)根據元素守恒,純堿與NO和NO2反應,生成NaNO2、NaNO3,且放出CO2,反應的化學方程式為①NO+NO2+Na2CO3═2NaNO2+CO2,②Na2CO3+2NO2═NaNO2+NaNO3+CO2,
故答案為:①NO+NO2+Na2CO3═2NaNO2+CO2;②Na2CO3+2NO2═NaNO2+NaNO3+CO2.
點評 本題綜合考查工業合成氨知識,涉及物質的分離、化學平衡的等問題,題目難度中等,注意把握物質的性質,注意合成氨條件的選擇.


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 海水淡化的主要方法有蒸餾法、電滲析法、離子交換法等 | |
| B. | 第①步中除去粗鹽中可溶性雜質,可依次加入Na2CO3、Ba(OH)2、鹽酸等試劑 | |
| C. | 在第②③④步中溴元素均被氧化 | |
| D. | 第④步涉及的分離操作有過濾、萃取、蒸餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在10%的NaOH溶液中,平均每9個水分子溶有1個OHˉ | |
| B. | 將10g碳酸鈣粉末加水配制成100mL溶液,CaCO3的物質的量濃度為1mol/L | |
| C. | 通入標準狀況下11.2LHCl氣體,可使1L 0.5mol/L的鹽酸的物質的量濃度增大一倍 | |
| D. | 已知某氫氧化鈉溶液中Na+與H2O的個數之比為1:a,則可求出此溶液中氫氧化鈉的質量分數$\frac{20}{20+9a}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ①③④⑤⑦ | D. | 全部都是 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
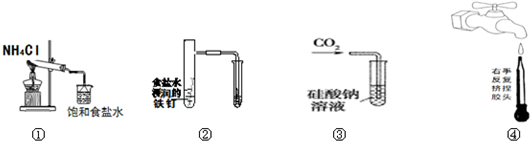
| A. | 實驗①制取的氨氣溶解在飽和NaCl溶液 | |
| B. | 實驗②通過觀察右邊試管有無倒吸現象說明鐵釘是否發生吸氧腐蝕 | |
| C. | 實驗③可用于證明碳的非金屬性比硅強 | |
| D. | 圖④是實驗室洗滌膠頭滴管的操作 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ④>③>②>① | B. | ④<③=②<① | C. | ①>②>③>④ | D. | ④>③=②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L苯分子數為NA | |
| B. | 1mol•L-1FeCl3溶液中所含Cl-的數目為3NA | |
| C. | 25℃,1.01×105Pa,14g乙烯所含的碳原子數為NA | |
| D. | 1molNa2SO4溶于水,所得溶液中Na+的數目為NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com