
| 物質 | 熔點(℃) | 沸點(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 濃硫酸(98%) | -- | 338.0 | 1.84 |

分析 (1)從濃硫酸溶于水放熱和加熱時試管內液體的體積不超過試管容積的1/3分析,實驗室用乙醇和乙酸在濃硫酸作用下加熱生成乙酸乙酯;
(2)乙酸具有酸性,能和飽和碳酸鈉溶液反應而把被吸收,乙酸乙酯在飽和碳酸鈉溶液中的溶解度較小;
(3)乙醇、乙酸的沸點較低,易揮發;
(4)根據乙酸的酸性和乙酸乙酯難溶于飽和碳酸鈉分析;
(5)從該裝置與傳統制備裝置的使用的儀器的不同進行分析.
解答 解:(1)乙醇中含有少量水,應將濃硫酸加入到乙醇中,防止硫酸溶解時放出大量的熱導致液體飛濺,另外,加熱時,試管內液體的體積不超過試管容積的1/3,加入藥品的順序為在一個30mL大試管中注入4mL乙醇,再分別緩緩加入4mL乙酸、1mL濃硫酸(乙酸和濃硫酸的加入順序可互換),邊加邊振蕩試管使之混合均勻(藥品總用量不能超過10mL);乙酸和乙醇發生的反應為:CH3COOH+CH3CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH3+H2O,
故答案為:在一個30 mL大試管中注入4 mL乙醇,再分別緩緩加入4 mL 乙酸、1 mL濃硫酸(乙酸和濃硫酸的加入順序可互換),邊加邊振蕩試管使之混合均勻;CH3COOH+CH3CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH3+H2O;
(2)乙酸具有酸性,能和飽和碳酸鈉溶液反應而把被吸收,乙酸乙酯在飽和碳酸鈉溶液中的溶解度較小,易于分離,
故答案為:BC;
(3)反應物中乙醇、乙酸的沸點較低,若用大火加熱,大量反應物隨產物蒸發而損失原料,溫度過高還可能發生其他副反應,所以為防止乙醇、乙酸揮發,造成原料的損失,應小火加熱,
故答案為:因為反應物乙醇、乙酸的沸點較低,若用大火加熱,反應物大量隨產物蒸發而損失原料,溫度過高可能發生其它副反應;
(4)碳酸鈉水解呈堿性,乙酸乙酯不溶于飽和碳酸鈉溶液,密度比水小,有香味,振蕩時乙酸和碳酸鈉反應而使溶液紅色變淺,
故答案為:試管B中的液體分成上下兩層,上層無色,下層為紅色液體,振蕩后下層液體的紅色變淺;
(5)從該裝置與傳統制備裝置的使用的儀器的不同進行分析,增加了溫度計,有利于控制發生裝置中反應液的溫度,根據反應的可逆性特點,增加反應物有利于平衡向正方向移動,提高乙酸乙酯的產量,增加了冷凝裝置,有利于收集產物,
故答案為:增加了溫度計,便于控制發生裝置中反應液的溫度,減少副產物的發生;增加了分液漏斗,有利于及時補充反應混合液,以提高乙酸乙酯的產量,或增加了冷凝裝置,有利于收集產物乙酸乙酯.
點評 本題主要考查了乙酸乙酯的制備,掌握乙酸乙酯的制備原理,以及運用原理理解實驗裝置的改進創新思路是解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 工業上合成氨的原理 | |
| B. | 工業上產生硫酸 | |
| C. | 熱的純堿溶液洗滌效果更好 | |
| D. | 受熱時,試管底部的NH4Cl部分轉移至試管上端 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

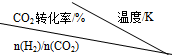 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 探究Na與水反應可能有O2生成 | |
| B. | 探究Na2O2與SO2反應可能有Na2SO4生成 | |
| C. | 探究NO2被NaOH溶液吸收可能生成NaNO3 | |
| D. | 探究FeCl3與KI溶液的反應可能是可逆反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向氯水中通入二氧化硫,氯水的漂白性增強 | |
| B. | 氯水中加入NaCl固體,對溶液的pH無影響 | |
| C. | 常溫下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的離子反應方程式為:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳元素的單質只存在金剛石和石墨兩種同素異形體 | |
| B. | Mg、MgO中鎂元素微粒的半徑:r(Mg2+)>r(Mg) | |
| C. | 粗硅$→_{高溫}^{Cl_{2}}$SiCl4$→_{高溫}^{H_{2}}$Si | |
| D. | Mg(OH)2$\stackrel{鹽酸}{→}$MgCl2(aq)$\stackrel{電解}{→}$Mg |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下0.001 mol/L和0.10 mol/L 的HNO2溶液,分別用pH計測它們的pH,兩者的pH相差小于2個單位 | |
| B. | 常溫下90mL0.1 mol•L-1 HNO2溶液導電性比10mL0.1 mol•L-1 HCl溶液弱 | |
| C. | 10mL0.1 mol•L-1的HNO2與0.1 mol•L-1的NaOH恰好完全反應時,消耗10mLNaOH | |
| D. | 濃度相同的 HNO2溶液與NaNO2溶液中,后者NO2-濃度大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com