


分析 (1)根據能量變化圖,則反應斷鍵共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以該反應共放出2797-2132=665kJ的熱量,據此書寫;
(2)①依據化學方程式和平衡常數概念書寫平衡常數表達式;
②增加甲醇產率需要平衡正向進行,依據平衡移動原理結合反應特征是氣體體積減小的放熱反應分析選項判斷;
(3)①分析圖象的曲線變化特征判斷,升高溫度,發現NO的分解率降低,說明反應向逆反應方向進行,該反應放熱;
②C2H6與NO2發生反應生成無毒的N2、CO2和H2O,由此書寫化學方程式;
(4)燃料電池的負極上發生燃料失去電子的氧化反應,即NO2+NO3--e-=N2O5.
解答 解:(1)根據能量變化圖,則反應斷鍵共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以該反應共放出2797-2132=665kJ的熱量,熱化學方程式為:2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=-665kJ•moL-1,所以氮氣和水蒸氣反應生成氫氣和一氧化氮的熱化學方程式是N2(g)+2H2O(g)═2NO(g)+2H2(g)△H=+665 kJ•mol-1,故答案為:N2(g)+2H2O(g)═2NO(g)+2H2(g)△H=+665 kJ•mol-1;
(2)①CO(g)+2H2(g)?CH3OH(g)△H<0,反應的平衡常數為:K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,
故答案為:K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
②A.升高溫度,平衡逆向進行,甲醇產率減小,故A錯誤;
B.將CH3OH(g)從體系中分離,平衡正向進行,甲醇產率增大,故B正確;
C.充入He,使體系總壓強增大,分壓不變,平衡不動,故C錯誤;
故答案為:B;
(3)①升高溫度,發現NO的分解率降低,說明反應向逆反應方向進行,該反應放熱;由圖可知,在$\frac{n(NO)}{n(CO)}$=1的條件下,870℃時,NO還原為N2的轉化率為100%,
故答案為:NO分解反應是放熱反應,升高溫度不利于反應進行;870℃或相近溫度;
②C2H6與NO2發生反應生成無毒的N2、CO2和H2O,所以化學方程式為4C2H6+14NO2$\frac{\underline{\;催化劑\;}}{\;}$8CO2+7N2+12H2O,故答案為:4C2H6+14NO2$\frac{\underline{\;催化劑\;}}{\;}$8CO2+7N2+12H2O;
(4)燃料電池的負極上發生燃料失去電子的氧化反應,即NO2+NO3--e-=N2O5,故答案為:NO2+NO3--e-=N2O5.
點評 本題考查了原電池原理、方程式的書寫、化學平衡常數、平衡移動等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 濃HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 麥芽糖及其水解產物均能發生眼鏡反應 | |
| B. | 可用新制Cu(OH)2,鑒別甲酸、乙醛和乙酸 | |
| C. | 用甘氨酸和丙氨酸縮合最多可形成4種二肽 | |
| D. | 淀粉和纖維素互為同分異構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | x<y | B. | x=y | C. | x>y | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
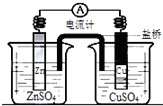
| A. | 銅是陽極,銅片上有氣泡產生 | |
| B. | 鋅離子在鋅片表面被還原 | |
| C. | 正極附近的SO${\;}_{4}^{2-}$離子濃度逐漸增大 | |
| D. | 鹽橋中的陽離子會移向CuSO4溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com