
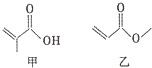
| A. | 甲、乙互為同分異構體 | |
| B. | 甲、乙都能與溴的單質發生加成反應 | |
| C. | 一定條件下,甲、乙均能發生取代反應 | |
| D. | 甲、乙都能與金屬鈉反應生成氫氣 |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 46g乙醇中存在的共價鍵總數為7NA | |
| B. | 1mol甲醇完全燃燒時,轉移的電子數為6NA | |
| C. | 標準狀況下,22.4L甲烷和22.4L氯仿所具有的微粒數均為NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氫離子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
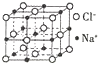 由C、N、O、Na、Fe五種元素組成的配合物Na2[Fe(CN)5(NO)]可用于治療高血壓急癥.
由C、N、O、Na、Fe五種元素組成的配合物Na2[Fe(CN)5(NO)]可用于治療高血壓急癥.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
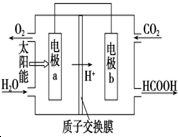 燃料的使用和防污染是社會發展中一個無法回避的矛盾話題.
燃料的使用和防污染是社會發展中一個無法回避的矛盾話題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
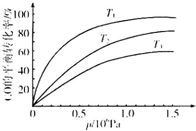 鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:
鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:| 溫度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 微粒組 | 加人試劑 | 發生反應的離子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com